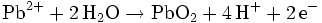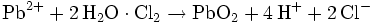- PbO2
-
Kristallstruktur 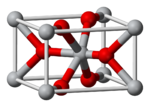
Kristallsystem tetragonal (Rutil-Typ) [1] Raumgruppe P42/mnm [1] Gitterkonstanten a=4,96 Å, c=3,38 Å [1] Koordinationszahlen Pb: 6, O: 3 [1] Allgemeines Name Blei(IV)-oxid Andere Namen - Bleidioxid
- Bleiperoxid
- Bleisuperoxid
Verhältnisformel PbO2 CAS-Nummer 1309-60-0 Kurzbeschreibung dunkelbraunes Pulver Eigenschaften Molare Masse 239,2 g/mol Aggregatzustand fest
Dichte 9,4 g·cm-3 [2]
Schmelzpunkt thermische Zersetzung: 290 °C [2]
Löslichkeit fast unlöslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 61-20/22-33-62-50/53 S: 53-45-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Blei(IV)-oxid ist eine Verbindung der Elemente Blei und Sauerstoff mit der Verhältnisformel PbO2. Es ist ein dunkelbraunes Pulver, das eine stark oxidierende Wirkung besitzt.
Inhaltsverzeichnis
Vorkommen
Natürlich kommt Blei(IV)-oxid als Mineral Plattnerit vor.[4]
Gewinnung und Darstellung
Blei(IV)-oxid wird technisch entweder über elektrolytische Oxidation oder über chemische Oxidation mit starken Oxidationsmitteln wie Chlor hergestellt:
Eigenschaften
Physikalische Eigenschaften
Es sind fünf Modifikationen von Blei(IV)-oxid bekannt. Sie lassen sich durch Druck- und Temperaturänderungen ineinander überführen. Bis zu einem Druck von 4 GPa (bei 200 °C 1,3 GPa) kristallisiert Blei(IV)-oxid in der tetragonalen β-Modifikation mit Rutilstruktur. Bei höheren Drücken bis zu 7 GPa (bei 300 °C 6 GPa) liegt die orthorhombische α-Struktur vor. Anschließend verändert sich die Struktur zu einem kubischen Kristallsystem und entspricht dabei einer defekten Fluorit-Struktur. Ab 11,4 GPa ist die Struktur orthorhombisch und entspricht derjenigen von Zirconiumdioxid. Ab 29 GPa liegt schließlich eine orthorhombische, dem Cotunnit entsprechende Struktur vor.[5]
Chemische Eigenschaften
α-PbO2 ist ein starkes Oxidationsmittel.
Es geht beim Erhitzen unter Abspaltung von Sauerstoff zuerst in das Blei(II,IV)-oxid-Mischoxid und oberhalb von 550°C in Blei(II)-oxid über.Verwendung
Aufgrund des hohen Oxidationsvermögens wird Bleidioxid sowohl großtechnisch als auch im Labor viel verwendet. Man verwendet es zur Herstellung von Farbstoffen, Chemikalien und als Reibmasse an Streichhölzern. Außerdem findet es Anwendung in der Feuerwerkerei, als Elektrode in Akkumulatoren und zur Härtung von Sulfidpolymeren.
Blei(IV)-oxid wird in der organischen Chemie als starkes Oxidationsmittel verwendet.
Sicherheitshinweise
Blei(IV)-oxid ist teratogen, gesundheitsschädlich und umweltgefährlich. Außerdem sollte es als cancerogen für den Menschen angesehen werden (Krebserzeugend: Kategorie 2).[6] Die maximale Arbeitsplatz-Konzentration beträgt 0,1 mg·m-3. Blei(IV)-oxid ist in die CH-Giftklasse 1 (sehr starke Gifte) eingestuft.[7]
Quellen
- ↑ a b c d P. D'Antonio: Powder Neutron Diffraction Study of Chemically Prepared β-Lead Dioxide, in: Acta Cryst., 1980, B36, 2394-2397
- ↑ a b Sicherheitsdatenblatt (Merck)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Bleiverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ Mineralienatlas: Plattnerit
- ↑ J. Haines, J. M. Léger and O. Schulte: "The high-pressure phase transition sequence from the rutile-type through to the cotunnite-type structure in PbO2", J. Phys.: Condens. Matter 1996, 8, S. 1631–1646. doi:10.1088/0953-8984/8/11/009
- ↑ Eintrag zu CAS-Nr. 1309-60-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2008 (JavaScript erforderlich)
- ↑ IGS-Giftliste
Wikimedia Foundation.