- Polylysin
-
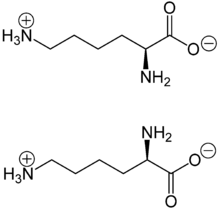
Strukturformel 
L-Lysin

D-LysinAllgemeines Name Lysin Andere Namen - (S)-Lysin
- L-Lysin
- (R)-Lysin
- D-Lysin
- 2,6-Diaminohexansäure
- Abkürzungen:
- Lys (Dreibuchstabencode)
- K (Einbuchstabencode)
Summenformel C6H14N2O2 CAS-Nummer - 56-87-1 (L-Enantiomer)
- 923-27-3 (D-Enantiomer)
- 657-27-2 (Monohydrochlorid)
ATC-Code DrugBank DB00123 Kurzbeschreibung farblose Nadeln oder hexagonale Plättchen [1] Eigenschaften Molare Masse 146,19 g·mol−1 Aggregatzustand fest
Schmelzpunkt - 224 °C (Zersetzung) [1] (freie Base)
- 263-264 °C (Monohydrochlorid)[2]
pKs-Wert - pKCOOH: 2,18
- pKα-NH2: 9,12
- pKSeitenkette: 10,53[3]
Sicherheitshinweise Gefahrstoffkennzeichnung [4] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln WGK 1[4] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lysin (Abk. Lys oder K) ist in seiner natürlichen L-Form eine essentielle proteinogene α-Aminosäure.
Inhaltsverzeichnis
Eigenschaften
Gemeinsam mit L-Arginin und L-Histidin gehört L-Lysin in die Gruppe der basischen und zugleich proteinogenen α-Aminosäuren oder Hexonbasen. Lysin besitzt zwei basische Amino-Gruppen, eine in α-Position zur Carboxylgruppe und eine in der ε-Position der Seitenkette. Die Ladung des Lysins ist - wie bei allen Aminosäuren - vom pH-abhängig (pK-Wert: ~10). Lysin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe zum einsamen Elektronenpaar des Stickstoffatoms der ω-Aminogruppe wandert, die stärker basisch ist als die α-Aminogruppe:[3]
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert, hier 9,82[5]) der Fall, bei dem das Lysin auch seine geringste Löslichkeit in Wasser besitzt.
- isoelektrischer Punkt: 9,82
- van-der-Waals-Volumen: 135
- Hydrophobizitätsgrad: −3,9
Stereoisomerie
In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Lysin [Synonym: (S)-Lysin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Lysin [Synonym: (R)-Lysin], das in Proteinen nicht vorkommt. Racemisches DL-Lysin [Synonyme: (RS)-Lysin und (±)-Lysin] eine geringere Bedeutung als L-Lysin, besitzt jedoch kommerzielle Bedeutung als basische Komponente in Arzneistoff-Salzen, z. B. mit Acetylsalicylsäure.
Industrielle Herstellung
Industriell werden mehrere 100 000 Tonnen L-Lysin pro Jahr hergestellt. L-Lysin wird heute ausschließlich nach der Fermentationsmethode hergestellt, obgleich alternative organisch-chemische Syntheserouten entwickelt wurden.[6]
Vorkommen
L-Lysin wurde erstmalig als Hydrolyseprodukt (gr. λύσιζ: Auflösung, Trennung) von Kasein (einem Milchprotein) isoliert. L-Lysin gehört für den Menschen zu den essentiellen Aminosäuren, es kann im Organismus nicht selbst hergestellt werden und muss deshalb mit der Nahrung aufgenommen werden. Dabei benötigt ein erwachsener Mensch etwa 14 mg L-Lysin pro Kilogramm Körpergewicht und Tag (Kinder ca. 10 J: 44 mg/kg pro Tag).
Besonders viel L-Lysin enthalten Parmesan, Fisch, Schweine- und Rinderfilet, Sojabohnen, Weizenkeime sowie Linsen und Erdnüsse. In 100 g sind enthalten:
- Parmesan-Käse 3170 mg
- Thunfisch 2210 mg
- Garnelen 2020 mg
- Schweinefilet 2120 mg
- Rinderfilet 2020 mg
- Weizenkeime 1900 mg
- Sojabohnen 1900 mg
- Linsen 1890 mg
- Huhn 1790 mg
- Erdnüsse 1100 mg
Funktionen
Lysin ist eine der Aminosäuren, die bevorzugt posttranslational modifiziert werden. Dabei kann die Ladung erhalten bleiben (mono- und di-Methylierung) oder verschwinden (Acetylierung). Im Kollagen wurde ein modifiziertes Lysin gefunden, das Hydroxylysin mit einer OH-Gruppe in der Seitenkette, katalysiert unter Mitwirkung des Enzyms Lysylhydroxylase und des Cofaktors Ascorbinsäure (Vitamin C). Hydroxylysin erlaubt die nachfolgende O-Glykosylierung des Kollagenmoleküls im endoplasmatischen Retikulum und Golgi-Apparat. Die Glykosylierung bestimmt die Packungsdichte dieses wichtigen Bindegewebeproteins und wird auch mit der Steuerung der Kollagenabgabe aus der Zelle (Exocytose) in Verbindung gebracht.
Beim Abbau des Lysin (Eiweißfäule) entsteht über Pipecolinsäure das Leichengift Kadaverin (Pentamethylendiamin).
Verwendung
Die Hauptmengen des industriell erzeugten L-Lysins werden in der Futtermittelsupplementierung eingesetzt, um den Nährwert natürlicher Futtermittel (Getreide) mit einem geringen Gehalt an L-Lysin deutlich zu steigern.[6] Racemisches DL-Lysin [Synonyme: (RS)-Lysin und (±)-Lysin] besitzt kommerzielle Bedeutung als basische Komponente in Arzneistoff-Salzen, z. B. mit Acetylsalicylsäure (ASS).
Biochemie
Für detaillierte Strukturformeln siehe auch Abschnitt Weblinks
L-Lysin kann in zwei Moleküle Acetyl-CoA abgebaut werden.
Einzelnachweise
- ↑ a b Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart, 1992.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 698, ISBN 978-0-911910-00-1.
- ↑ a b Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2, dort Seite 40.
- ↑ a b Sicherheitsdatenblatt Sigma-Aldrich
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ a b Izumi, Y. et al. (1978): Herstellung und Verwendung von Aminosäuren. In: Angewandte Chemie 90(3) (1978) 187–194; doi:10.1002/ange.19780900307
Weblinks
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.