- Potentiometrie
-
Die Potentiometrie ist ein elektroanalytisches Verfahren der quantitativen Analyse unter Vermeidung eines Stromflusses und nutzt die Konzentrationsabhängigkeit der elektromotorischen Kraft (häufig auch elektrochemisches Potential genannt).
Bei der potentiometrischen Titration (Maßanalyse mit potentiometrischer Indikation) taucht eine Indikatorelektrode (z. B. pH-Elektrode, Redoxelektrode) in eine Analysenlösung, und es wird die Potentialänderung in Abhängigkeit von einer zugegebenen Reagenzlösung verfolgt. Am Äquivalenzpunkt ändert sich die Konzentration und damit die elektromotorische Kraft und das Potential kräftig. Mit der Potentiometrie lassen sich Säure-, Base-, Redox-, Fällungs-, Komplexbildungstitrationen durchführen, es lassen sich auch Dissoziationskonstanten, Löslichkeitsprodukte ermitteln. Gefärbte, getrübte Lösungen können potentiometrisch titriert werden. Mit pH-Elektroden können Säure-, Basetitrationen auch in stark verdünnten Lösungen (10-4 mol Säure/Base) vorgenommen werden.
Die Potentiometrie wurde 1893 von Robert Behrend eingeführt.
Inhaltsverzeichnis
Verfahren
Potentiometrische Indikatorelektroden wie Glaselektroden zur pH-Messung und Redoxelektroden sind heutzutage leicht verfügbar. Mit diesen Elektroden kann sofort pH-Wert oder Redoxpotential abgelesen werden.
Neben diesen gebräuchlichen Elektroden gibt es noch ionenselektive Elektroden. Mit der Silber/Silbersulfid-Elektrode lassen sich Halogenid-, Sulfid-, Cyanid-, Thiocyanat- oder Chromationen durch Titration mit einer eingestellten Silbernitratlösung bestimmen. Mit Flüssig-Membran-Elektroden lassen sich Ionenkonzentrationen von Kalium, Magnesium, Kalzium oder Nitrat bestimmen. Auch für komplexometrische Titrationen lassen sich ionensensitive Elektroden einsetzen. Als Titrant bei komplexometrischen Bestimmungen dient überwiegend Ethylendiamintetraessigsäure (EDTA).
Man verwendet die Potentiometrie in zwei Verfahren:- Das Indikationsverfahren stellt eine spezielle Form der Titration dar. Dazu wird die Änderung der elektromotorischen Kraft während einer Titration aufgenommen und anschließend der Äquivalenzpunkt bestimmt. Dieses Verfahren wird immer dann angewendet, wenn eine normale Titration nicht durchgeführt werden kann. Dies kann der Fall sein, wenn kein geeigneter Indikator vorhanden ist oder die Lösung so trübe oder farbig ist, dass der Umschlagspunkt nicht erkannt werden kann.
- Das Bestimmungsverfahren beruht auf einer Konzentrationsbestimmung durch Messen des zugehörigen elektrochemischen Potentials; die Auswertung erfolgt anhand einer mit dem gleichen Messaufbau erstellten Kalibrationsgeraden.
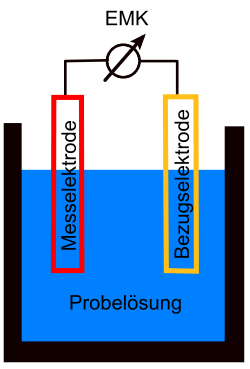
Versuchsaufbau
Früher wurde zunächst eine galvanische Zelle aus zwei Elektroden und der Probelösung als Elektrolyt aufgebaut. Die Differenz aus den Potentialen der beiden Elektroden ist als die elektromotorische Kraft EMK definiert:
- EMK = | E1 − E2 |
Zum Aufbau verwendet man eine Elektrode, die Bezugselektrode, von der das Potential sehr genau bekannt und konstant ist. Im allgemeinen wird dazu eine Elektrode 2. Art verwendet. In der Praxis sind dies meist eine Kalomel-Elektrode oder eine Silber-Silberchlorid-Elektrode. Die Spannungsdifferenz zwischen der Bezugselektrode und der in die Lösung eintauchenden Messelektrode ist über ein Spannungsmessgerät bestimmbar. Die Wahl der Messelektrode hängt stark von der Titrationsart ab. Man verwendet für die
- Redox-Titration eine Platin-Elektrode,
- komplexometrische Bestimmung entweder eine ionensensitive Elektrode oder eine abgewandelte Silber-Elektrode,
- Säure-Base-Titration eine Glaselektrode,
- Argentometrie eine Silberelektrode.
Die Messelektrode taucht in die Probelösung ein und muss auf das zu bestimmende Ion ansprechen, das heißt, das Potential dieser Elektrode muss abhängig sein von der Konzentration des zu bestimmenden Ions. Diese Abhängigkeit wird durch die Nernst-Gleichung beschrieben. Bei dem Versuch ist darauf zu achten, dass die Messung stromlos erfolgt, da sich sonst durch Elektrolyse die Potentiale verfälschen würden. Man verwendet daher zur Messung eine Poggendorffsche Kompensationsschaltung.
Auswertung
Die Auswertung erfolgt mittels Bestimmung des Äquivalenzpunktes. Am besten erkennt man den Äquivalenzpunkt, wenn man die 1. Ableitung der Titrationskurve im Diagramm darstellt. Das Maximum gibt den Äquivalenzpunkt an. Auf die x-Achse trägt man das Volumen der titrierten Lösung in ml und auf der y-Achse das gemessene Potential in mV auf.
Will man einen bestimmten Gehalt berechnen, so sind zwei Formeln anzuwenden:
 mit
mit
- n = Stoffmenge in mol
- c = Konzentration in mol/l
- V = Volumen der Titration in l
- f = Titerfaktor (ist der Titerfaktor nicht bekannt, setzt man f = 1)
 mit
mit
- m = Masse in g
- M = molare Masse in g/mol
Zu beachten ist, dass das Ergebnis auf insgesamt 100 ml Probenlösung bezogen wird; das Ergebnis ist ggf. entsprechend anzupassen.
Literatur
- Georg Schwedt: Analytische Chemie, S.170 ff., Wiley VCH Verlagsgesellschaft, 2. Auflage, Weinheim 2008, ISBN 978-3-527-31206-1
- Ullmanns Encyklopädie der technischen Chemie, 3. + 4. Auflage, Stichwort: Elektrochemische Analyseverfahren
Weblinks
Kategorien:- Chemisches Analyseverfahren
- Elektrochemie
Wikimedia Foundation.