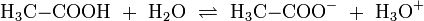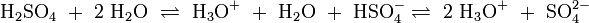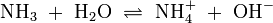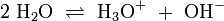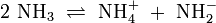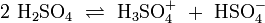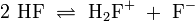- Autoprotolyse
-
Die Protolyse (oder auch protolytische Reaktion) ist eine chemische Reaktion, bei der ein Proton (H+) zwischen zwei Reaktionspartnern übertragen wird. Mit dem Begriff Protolyse wird häufig fälschlich die Abspaltung von Protonen beschrieben. Das ist nicht korrekt. Die Protolyse ist der entscheidende Vorgang nach der wichtigen Brønstedschen Säure-Base-Theorie. Danach überträgt eine Säure ein Proton (H+) an einen Reaktionspartner. Die als Säure bezeichnete Verbindung wirkt als Protonenspender (Protonendonator), die Base (häufig Wasser) nimmt die Protonen auf und wird daher als Protonenakzeptor bezeichnet. Zwischen den Reaktionspartnern stellt sich ein chemisches Gleichgewicht ein.
Inhaltsverzeichnis
Protolytische Reaktionen
Wird das Gas Chlorwasserstoff (HCl) in Wasser eingebracht, bildet sich unter Protolyse die Salzsäure. In dieser Gleichgewichtsreaktion sind das Molekül HCl und das Ion H3O+ Protonendonatoren, also nach Brønsted Säuren. H2O und Cl− wirken als Protonenakzeptoren, sie sind nach Brønsted also Basen.
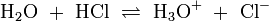 .
.
Wird beispielsweise reine Essigsäure (H3C–COOH) in Wasser gegeben bilden sich unter Protolyse H3O+ und das Acetat-Anion (H3C–COO−). Hier sind CH3COOH und H3O+ Protonendonatoren, während H3C–COO− und H2O Protonenakzeptoren sind.
Protolyse der zweiprotonigen Verbindung Schwefelsäure in Wasser:
In dieser Reaktionsgleichung sind die Moleküle H2SO4 und das Ion H3O+ Protonendonatoren, also nach Brønsted Säuren. H2O und SO42− wirken als Protonenakzeptoren, sie sind nach Brønsted also Basen. Eine besondere Rolle spielt HSO4−, das je nach Reaktionsrichtung als Protonenakzeptor oder Protonendonator reagieren kann. Man bezeichnet Substanzen mit solchen Eigenschaften als Ampholyte.
Wird das Gas Ammoniak (NH3) in Wasser eingeleitet, bilden sich Ammonium-Ionen (NH4+) und Hydroxid-Ionen (OH−). Protonendonatoren sind hier NH4+ und H2O, während OH− und NH3 Protonenakzeptoren sind.
Autoprotolyse
Reines Wasser unterliegt einer sogenannten Autoprotolyse. Hierbei entstehen Oxoniumionen H3O+ und Hydroxidionen (OH−). H2O kann sowohl als Protonendonator (als Säure) oder als Protonenakzeptor (als Base) reagieren. Man spricht daher auch hier von einem Ampholyten.
Das Gleichgewicht liegt sehr stark auf Seite des Wassers. Das Ionenprodukt für diese Reaktion beträgt bei 298 K (25 °C) 10−14 mol2 l−2. Die Autoprotolyse des Wassers ist der Grund dafür, dass auch chemisch reines Wasser eine zumindest geringe elektrische Leitfähigkeit besitzt. Eine Anwendung der Autoprotolyse zur elektrischen Ladungstrennung findet sich bei dem Kelvin-Generator, wenn dieser mit chemisch reinem Wasser betrieben wird.
Die Autoprotolyse ist deutlich abhängig von der Temperatur. So betragen die Ionenprodukte (in mol2 l-2):
- bei 0 °C 0,11 · 10−14, also rund 10−15
- bei 60 °C 9,61 · 10−14, also rund 10−13
- bei 100 °C 5,483 · 10−13
Dementsprechend ist auch der pH-Wert von Wasser temperaturabhängig. Damit ergibt sich für
- reines Wasser bei 0 °C ein pH von 7,5
- reines Wasser bei 25 °C ein pH von 7,0
- reines Wasser bei 60 °C ein pH von 6,5
- reines Wasser von 100 °C ein pH von 6,13
Protolyse in nichtwässrigen Lösungen
In Brønstedschen Säure-Base-Reaktionen können neben Wasser auch andere hinreichend polare Lösungsmittel als Reaktionspartner dienen, zum Beispiel Methanol oder Ethanol. Ein gutes Beispiel ist die Autoprotolyse des flüssigen Ammoniaks. Es bilden sich die Ionen Ammonium und Amid.
Ionenprodukt = 10−32
Auch in konzentrierter Schwefelsäure sind analoge Reaktionen bekannt:
pKs = 3,57
Ebenso von Fluorwasserstoff:
Ionenprodukt = 10−10,7 (0 °C)
Weblinks
- http://www.seilnacht.com/Lexikon/Saeuren.htm#broenstedt (Protolyse)
- http://www.seilnacht.com/Lexikon/ampholyt.html (Ampholyt, Autoprotolyse)
Wikimedia Foundation.