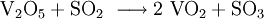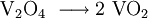- Vanadiumdioxid
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Vanadium(IV)-oxid Andere Namen Vanadiumdioxid
Verhältnisformel VO2 CAS-Nummer 12036-21-4 PubChem 82849 Kurzbeschreibung schwarzer kristalliner Feststoff Eigenschaften Molare Masse 82,94 g·mol−1 Aggregatzustand fest
Dichte 4,339 g·cm−3[1]
Schmelzpunkt 1970 °C[1]
Löslichkeit unlöslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36/37/39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Vanadium(IV)-oxid ist eines von mehreren Oxiden des Vanadiums. Es ist ein hochschmelzender, schwarzer Feststoff. Vanadium(IV)-oxid spielt eine wichtige Rolle bei der katalytischen Umsetzung von Schwefeldioxid zu Schwefeltrioxid im Kontaktverfahren zur Schwefelsäureherstellung.
Inhaltsverzeichnis
Gewinnung und Darstellung
Vanadium(IV)-oxid lässt sich aus Vanadium(V)-oxid gewinnen. Dieses wandelt sich beim Erhitzen mit schwachen Reduktionsmitteln, wie Kohlenstoffmonoxid, Schwefeldioxid oder Oxalsäure in Vanadium(IV)-oxid um:
Eigenschaften
Physikalische Eigenschaften
Vanadium(IV)-oxid besitzt zwei verschiedene Modifikationen, die sich bei 70 °C ineinander umwandeln. Unterhalb von 70 °C besitzt es eine verzerrte Rutil-Struktur, in der jeweils zwei Vandiumatome durch eine Bindung miteinander verbunden sind. Oberhalb von 70 °C brechen diese Bindungen auf. Dabei bildet sich eine unverzerrte Rutilstruktur aus. Gleichzeitig erhöht sich die elektrische Leitfähigkeit und der Paramagnetismus deutlich.
Chemische Eigenschaften
Vanadium(IV)-oxid ist wie Titan(IV)-oxid amphoter, es löst sich sowohl in starken Säuren, als auch in starken Basen. Mit Säuren bildet es [VO(H2O)5]2+-Ionen, mit Basen [VO(OH)3]--Ionen.
Verwendung
Während der Schwefelsäureproduktion im Kontaktverfahren entsteht durch Übertragung eines Sauerstoffions vom Vanadium(V)-oxid auf das Schwefeldioxid Vanadium(IV)-oxid. Die Rückgewinnung des eingesetzten Vanadium(V)-oxids erfolgt durch Oxidation mit Sauerstoff.
Bedingt durch die Umwandlung zwischen den unterschiedlichen Phasen lässt sich Vanadium(IV)-oxid als optischer Schalter verwenden. Es wandelt sich bei 68 °C in kürzester Zeit von einem durchsichtigen und halbleitenden in einen spiegelnden und leitenden Zustand um.[2] Durch Einbringen geringer Mengen Wolfram in Vanadiumdioxid lässt sich die Umwandlungstemperatur auf etwa 29 °C senken, was das Oxid zur hitzeabweisenden Beschichtung von Glasflächen geeignet macht.[3][4]
Einzelnachweise
- ↑ a b c Eintrag zu Vanadium(IV)-oxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 6. Juli 2008 (JavaScript erforderlich)
- ↑ Leonard C. Feldman: Timing nature’s fastest optical shutter, physorgs.com, 7. April 2005.
- ↑ Spektrumdirekt: Glasbeschichtung lässt Hitze draußen. Meldung vom 9. August 2004.
- ↑ Troy D. Manning and Ivan P. Parkin: "Atmospheric pressure chemical vapour deposition of tungsten doped vanadium(IV) oxide from VOCl3, water and WCl6", Journal of Materials Chemistry 2004, 14, 2554–2559; doi:10.1039/b403576n.
Literatur
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 1548, ISBN 978-3-11-017770-1.
Wikimedia Foundation.