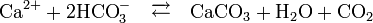- Blätterspat
-
Calcit (Kalzit, Kalkspat) Chemische Formel Ca[CO3] Mineralklasse wasserfreie Carbonate ohne fremde Anionen
5.AB.05 (8. Auflage: 5/B.02-20) (nach Strunz)
14.1.1.1 (nach Dana)Kristallsystem trigonal Kristallklasse ditrigonal-skalenoedrisch 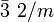
Farbe meist farblos, milchig weiß, grau, gelb, rosa, rot, blau, grün, braun bis schwarz Strichfarbe weiß Mohshärte 3 Dichte (g/cm³) 2,6 bis 2,8 rein 2,715
Glanz Glasglanz, auch Perlmuttglanz Transparenz durchsichtig bis undurchsichtig Bruch muschelig, spröde Spaltbarkeit sehr vollkommen nach 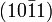
Spaltwinkel 75°
Habitus sehr unterschiedlich, Konkretionen, oolithisch, stalaktitisch, körnig, massig Häufige Kristallflächen 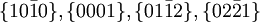
Zwillingsbildung (0001), sehr häufig Gleitzwillinge (polynynthetische Translationslamellen) nach 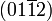
Kristalloptik Brechzahl bei ~590nm:
nω=1,640 bis 1,660 rein 1,658 nε=1,486
Im Bereich von 190 bis 1700 nm fällt nω von etwa 1,6 auf etwa 1,4, während nε von etwa 1,9 auf etwa 1,5 fällt[1].Doppelbrechung
(optische Orientierung)Δ=0,154 bis 0,174 rein 0,172 ; einachsig negativ
Winkel/Dispersion
der optischen Achsen2vz ~ kann anomal zweiachsig auftreten 2Vx dann 4-14° (bis 25°)
Pleochroismus nicht vorhanden Weitere Eigenschaften Chemisches Verhalten in kalten, verdünnten Säuren unter heftigem Brausen löslich Ähnliche Minerale Aragonit, Dolomit Radioaktivität nicht radioaktiv Magnetismus nicht magnetisch Besondere Kennzeichen sehr starke Doppelbrechung, teilweise Fluoreszenz in rot oder orange, häufige Zwillingslamellen Calcit, auch Kalzit oder Kalkspat, ist ein sehr häufig vorkommendes Mineral aus der Mineralklasse der wasserfreien Carbonate ohne fremde Anionen. Es kristallisiert im trigonalen Kristallsystem mit der chemischen Zusammensetzung Ca[CO3] und entwickelt verschiedene Kristall- beziehungsweise Aggregat-formen (Habitus), die entweder farblos oder von milchig weißer bis grauer, durch Verunreinigungen auch gelber, rosa, roter, blauer, grüner, brauner oder schwarzer Farbe sein können.
Calcit gehört zusammen mit Gaspeit, Magnesit, Otavit, Rhodochrosit, Siderit, Smithsonit, Sphärocobaltit und Vaterit zur gleichnamigen Calcitgruppe.
Inhaltsverzeichnis
Besondere Eigenschaften
Chemisch gesehen ist Calcit, wie der ähnliche Aragonit und der Vaterit ein Calciumcarbonat, also ein Calcium-Salz der Kohlensäure.
 Illustration der hohen Doppelbrechung eines Calcitkristalls
Illustration der hohen Doppelbrechung eines CalcitkristallsCharakteristisch für Calcitkristalle ist eine besonders hohe Doppelbrechung. Licht, das nicht entlang der optischen Achse des Kristalls einfällt, wird in zwei Lichtbündel aufgespalten, einen ordentlichen und einen außerordentlichen. Für diese beiden Strahlen gilt auf Grund unterschiedlicher Polarisationsrichtungen eine andere Brechzahl. Dies zeigt sich darin, dass bei einem bestimmten Blickwinkel jedes durch einen klaren Kristall beobachtete Objekt doppelt erscheint, eine zur Identifikation von Calcit sehr hilfreiche Eigenschaft, daher auch der häufige Name Doppelspat. Er wird aufgrund dieser Eigenschaft auch als anisotrop beschrieben.
Verglichen mit anderen Mineralen ist Calcit kaum resistent gegenüber der Verwitterung. Er ist viel weicher als Quarz oder Feldspat und vornehmlich in saurem Wasser löslich.
Etymologie und Geschichte
Der Name Calcit leitet sich aus dem griechischen χάλιξ chálix (m und f; „Mörtel, Kalk, Kies“) beziehungsweise lateinischen calx ab, was jeweils Kalk bedeutet.
Bildung und Fundorte
Gebildet wird Calcit nach dem chemischen Gleichgewicht:
Das Gleichgewicht der obigen Reaktion verlagert sich mit steigender Temperatur zunehmend auf die rechte Seite. In warmen Gewässern können Lebewesen also mit geringerem Energieaufwand Kalzitgehäuse bilden. In Dampfkesseln und anderen Gefäßen, in welchen kalkhaltiges Wasser erhitzt wird, entsteht auf diese Weise Kesselstein.
Calcit kann sowohl massiv als auch körnig, faserig oder kristallin auftreten und zeigt in letzterem Falle den höchsten Formenreichtum aller Minerale. Es ist als Gestein bildendes Mineral eines der häufigsten der Erdkruste und kommt sowohl in magmatischen Gesteinen, zum Beispiel in Karbonatiten, in metamorphen Gesteinen (Marmor) oder Sedimentgesteinen wie Kalkstein vor. Es tritt alleine oder mit anderen Mineralen vergesellschaftet in Gängen auf, entsteht aber auch an der Erdoberfläche. Häufig entstand/entsteht Calcit durch Biomineralisation, sei es in Gesteinsformationen, im Boden, als in Teilen unerwünschter Zahnbelag (neben bevorzugt Calcium-Hydroxylapatit) usw.; hier aber immer in ganz bestimmten Mikro-Umweltbedingungen (Schmittner und Giresse, 1999).
Calcit löst sich gut in säurehaltigem Wasser und wird dadurch leicht zum Beispiel aus Kalkstein ausgelaugt, wodurch Höhlensysteme entstehen. Der gelöste Calcit lagert sich an anderer Stelle wieder ab. Dabei entstehen die für Tropfsteinhöhlen typischen Tropfsteine, die Stalagmiten und Stalaktiten.
Die weitaus größten Calcitvorkommen gehen auf Meeresablagerungen zurück. Dabei setzen sich die calcithaltigen Skelette und Schalen unzähliger kleiner Meerestiere wie etwa Muscheln, Korallen und diverser Protisten wie die Coccolithophoriden am Meeresgrund ab. Diese Kalkalgen werden mit einer Größe von weniger als 30 Mikrometern zum Nanoplankton gezählt und bilden winzige Kalkschilde, die so genannten Coccolithen, die nach dem Absterben der Algen auf den Ozeanboden sinken. Beispielsweise bestehen die Kreidefelsen von Dover aus solchen Coccolithen. Auch Korallenriffe spielen bei der Calcitbildung eine herausragende Rolle.
Anorganische, abiogene Bildungsbereiche von Calcit sind flache, im Intertidalbereich gelegene, tropische Meeresplattformen. Dort wird Calcit in Form von millimeterkleinen Kügelchen (Kalkooiden) ausgefällt. Calcit in Marmor geht auf thermische Metamorphose von Calcitsedimenten zurück.
Ab einer Meerestiefe von 3500 Metern, der so genannten Calcit-Kompensationstiefe, löst sich Calcit vollständig in Wasser. Daher bleiben in dieser Tiefe weder calcithaltige Sedimente noch Muschelschalen oder Skelette erhalten.
Des Weiteren kommt Calcit als Einlagerung in die Statolithenmembran der Makulaorgane des Innenohres vor. Es spielt dort eine große Rolle bei der Wahrnehmung von Beschleunigungen und der Lotrichtung - siehe Gleichgewichtsorgan.
Verwendung
als Rohstoff
Der calcithaltige Marmor, Kalkstein und Onyxmarmor ist ein hochwertiges Dekorations- und Baumaterial, daneben wird Calcit in Kalkstein zur Produktion von Zement und Kunstdünger und bei der Verhüttung von Metallerzen eingesetzt. Besonders reine Kristalle finden wegen ihrer optischen Eigenschaften Verwendung in der optischen Industrie. Außerdem wird es in basischen Elektroden zum Lichtbogenhandschweißen eingesetzt.
als Schmuckstein
Calcit ist für eine kommerzielle Verarbeitung als Schmuckstein eigentlich zu weich. Gelegentlich wird er aber dennoch im Glattschliff als Cabochon oder Trommelstein angeboten. Versierten Sammlern gelingt es darüber hinaus auch, Calcit in Facettenform (Treppenschliff) zu bringen. [2]
als Terrariensand
Aufgrund der Säurelöslichkeit wird Calcit in Form von Caltrat in Terrarien eingesetzt. Terrarientiere die auf herkömmlichem (unverdaulichem) Fluss- und/oder Quarzsanden gehalten worden waren, litten nach der Aufnahme dieser Sande an oft tödlich verlaufenden Verstopfungen. Durch die Verwendung von (verdaulichem) Caltrat wird diese Gefahr weitgehend ausgeschlossen.
Einzelnachweise
- ↑ Thompson, D.W. et al 1998. Determination of optical anisotropy in calcite from ultraviolet to mid-infrared by generalized ellipsometry. Thin Solid Films 313-314 (1998) 341-346. http://dx.doi.org/10.1016/S0040-6090(97)00843-2
- ↑ Walter Schumann: Edelsteine und Schmucksteine. 13. Auflage. BLV Verlags GmbH, 1976/1989, ISBN 3-405-16332-3 (S. 224)
Literatur
- Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer Verlag, Berlin, Heidelberg, New York 2005, ISBN 3-540-23812-3
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. Nebel Verlag GmbH, Eggolsheim 2002, ISBN 3-89555-076-0
- W. E. Tröger, H.U. Bambauer, F. Taborszky und H. D. Trochim (1981): Optische Bestimmung gesteinsbildender Minerale, Teil 1: Bestimmungstabellen. Stuttgart (Schweizerbart).
- Schmittner Karl-Erich und Giresse Pierre, 1999. Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France. Sedimentology 46/3: 463-476.
Siehe auch
Weblinks
- Mineralienatlas:Calcit (Wiki)
- Caltrat-Terrariensand
- Isländischer Spat Calcit
- Chinesische Riesencalcite
- Webmineral (engl.)
- MinDat - Calcite (engl.)
- Calcit aus dem Harz
Wikimedia Foundation.