- Caesiumchromat
-
Strukturformel 
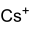
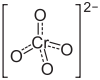
Allgemeines Name Caesiumchromat Summenformel Cs2CrO4 CAS-Nummer 13454-78-9 PubChem 61613 Kurzbeschreibung gelber, geruchloser Feststoff[1]
Eigenschaften Molare Masse 381,8 g·mol−1 Aggregatzustand fest
Dichte 4,24 g·cm−3 (20 °C)[1]
Löslichkeit gut in Wasser (712 g·l−1 bei 13 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 350i-400-410-317 EUH: keine EUH-Sätze P: 261-280-302+352-321-405-501 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-43-50/53 S: 53-45-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Caesiumchromat ist eine chemische Verbindung aus der Stoffgruppe der Chromate. Es handelt sich um das Caesiumsalz der Chromsäure. Die Verbindung ist ein giftiges, gelbes Pulver.
Inhaltsverzeichnis
Gewinnung und Darstellung
Caesiumchromat kann durch die Reaktion von Caesiumcarbonat mit Chrom(VI)-oxid gewonnen werden.[3]
Eigenschaften
Caesiumchromat kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma mit den Gitterparametern a = 8,43 Å, b = 6,30 Å und c = 11,20 Å, sowie vier Formeleinheiten pro Elementarzelle.[4]
Wird Caesiumdichromat mit Zirconium erhitzt, so reagiert es zu elementarem Caesium, Chrom(III)-oxid und Zirconium(IV)-oxid.[5]
Verwendung
Das Gemisch von Caesiumchromat und Zirconium kann zu Herstellung von elementarem Caesium[6] und in Vakuumröhren verwendet werden. Dort entsteht beim Erhitzen des Gemisches ebenfalls dampfförmiges Caesium, das mit Restspuren an Wasser oder Sauerstoff reagiert und so für ein besseres Vakuum sorgt.[5]
Sicherheitshinweise
Wie andere Chromate kann auch Caesiumchromat Krebs erzeugen.[1]
Einzelnachweise
- ↑ a b c d e f Datenblatt Caesiumchromat bei AlfaAesar, abgerufen am 14. Februar 2009 (JavaScript erforderlich).
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Chrom(VI)verbindungen“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. September 2009 (JavaScript erforderlich)
- ↑ I. V. Vinarov, I. B. Fraiman, S. A. Kolach: Complex preparation of reactive pure cesium salts from cesium chloride. In: Khimicheskaya Tekhnologiya (Kharkov). 1966, 6, S. 98-102.
- ↑ Alan J. Morris, Colin H. L. Kennard, Frank H. Moore, Graham Smith, Henry Montgomery: Cesium chromate, CrCs2O4 [by neutron diffraction]. In: Crystal Structure Communications . 1981, 2, 10, S. 529-32.
- ↑ a b Helmut Sitzmann: Caesium-Verbindungen. In: Römpp Chemie-Lexikon, Thieme Verlag, Stand Mai 2005.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1273.
Kategorien:- Krebserzeugender Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Caesiumverbindung
- Chromat
Wikimedia Foundation.


