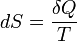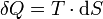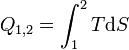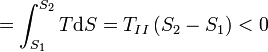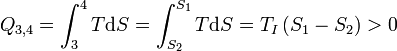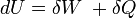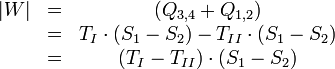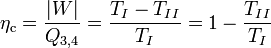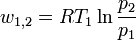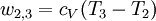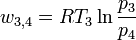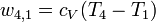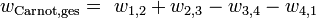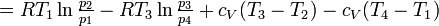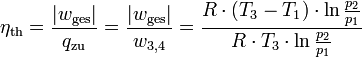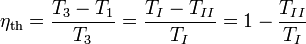- Carnotscher Kreisprozess
-
Der Carnot-Kreisprozess ist ein Kreisprozess von besonderer Bedeutung in der Thermodynamik. Er ist ein rein theoretischer Prozess. Seine Bedeutung besteht darin, dass er das Optimum angibt, das von keinem speziellen Kreisprozess, bei dem sich das Arbeitsfluid zwischen denselben Temperaturen bewegt, übertroffen werden kann. Der aus den Arbeitstemperaturen ermittelte Carnot-Wirkungsgrad (Carnot-Faktor) gibt an, welcher Anteil der zugeführten Wärme maximal in mechanische Arbeit umgewandelt werden kann. Daran werden alle anderen, den speziellen Maschinenanlagen angepasste Vergleichsprozesse, z. B. der Otto-Prozess als Vergleichsprozess für den Ottomotor oder der Clausius-Rankine-Prozess als Vergleichsprozess für das Dampfkraftwerk, gemessen.
Der Prozess wurde von dem französischen Offizier, Ingenieur und Physiker Nicolas Léonard Sadi Carnot entwickelt. Historisch begründeten Carnots Betrachtungen das wissenschaftliche Gebiet der Thermodynamik.
Inhaltsverzeichnis
Beschreibung
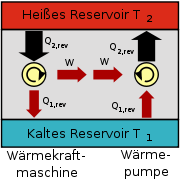 Der Carnot-Prozess als Wärmekraftmaschine oder Wärmepumpe; Der Drehrichtungspfeil gibt den zeitlichen Ablauf der einzelnen im T-s-Diagramm dargestellten Zustandsänderungen an
Der Carnot-Prozess als Wärmekraftmaschine oder Wärmepumpe; Der Drehrichtungspfeil gibt den zeitlichen Ablauf der einzelnen im T-s-Diagramm dargestellten Zustandsänderungen anDen Ablauf des Carnot-Prozesses kann man sich so vorstellen, dass ein Fluid (Gas oder Dampf) wechselweise mit einem Wärmereservoir von konstant hoher Temperatur (zur Aufnahme von Wärme) und einem Wärmereservoir mit konstant niedrigerer Temperatur (zur Abgabe von Wärme) in Kontakt steht, wobei es wechselweise durch Aufbringen mechanischer Arbeit verdichtet wird und unter Abgabe von mechanischer Arbeit wieder expandiert. Die Differenz zwischen aufgenommener und abgegebener Wärme entspricht im reversiblen Fall der vom Kreisprozess im T-s-Diagramm eingeschlossenen Fläche. Sie ist genau gleich der insgesamt gewonnenen mechanischen Arbeit. Das Gas erreicht nach vollständigem Durchlauf des Prozesses wieder den Ausgangszustand, d. h. alle Zustandsgrößen, wie Temperatur T, Druck p, Volumen V und innere Energie U sind damit wieder so groß wie zu Beginn des Prozesses. Der Prozess ist als ideale Wärmekraftmaschine (rechtsdrehend im T-s-Diagramm) oder als ideale Wärmepumpe bzw. Kältemaschine (linksdrehend) denkbar, wobei die im Wärmekraft-Prozess gewonnene technische Arbeit im Wärmepumpen-Prozess verlustfrei eingesetzt werden kann, um die beim Wärmekraft-Prozess an das kalte Wärmereservoir (Umgebung) abgegebene Wärme – zusammen mit der in Wärme umgewandelten Antriebsarbeit der Wärmepumpe (Rechteckfläche) – in das heiße Wärmereservoir wieder „hochzupumpen“. Aufgrund dieser Umkehrbarkeit wird der Prozess als reversibel bezeichnet. Der Prozess wäre mit einer periodisch arbeitenden Maschinenanlage nur unter besonders hohem Aufwand und auch nur angenähert realisierbar. Bezüglich eines Prozesses mit Gasen: Es gibt keine Verdichter und keine Expansionsmaschinen, die in einem Arbeitsgang auch die Wärmeübertragung ermöglichen, sodass die Temperatur dabei konstant bleibt. Bezüglich des Prozesses mit Nassdampf: Es gibt zwar Nassdampfturbinen, aber keine Verdichter, die Nassdampf zu Flüssigkeit komprimieren. Außerdem treten in allen Maschinen und bei allen Strömungsvorgängen Reibungsverluste auf.
Darstellung im T-S-Diagramm
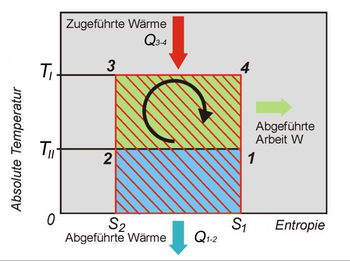 T-S-Diagramm des Carnot-Prozesses (Wärmekraftmaschine)
T-S-Diagramm des Carnot-Prozesses (Wärmekraftmaschine)Der Carnot-Prozess besteht aus zwei isothermen und zwei isentropen Zustandsänderungen, die im T-S-Diagramm ein Rechteck bilden. Die Entropiezunahme ist in einem reversiblen Prozess mit der zugeführten Wärme und der absoluten Temperatur verknüpft über die Gleichung:
und nach δQ aufgelöst:
Der Kreisprozess besteht aus folgenden Teilprozessen:
1. Zustandsänderung (1→2): Isotherme Kompression
Im Kontakt mit dem kalten Wärmereservoir wird dem Arbeitsgas bei konstanter Temperatur (isotherm) eine Wärmemenge Q1,2 entzogen. Dies führt zu einer Verringerung des Volumens von V1 zu V2.
Die abgeführte Wärmemenge wird beschrieben durch:
Der Wert für die Wärmemenge wird negativ, d. h. die Wärme wird aus dem System abgezogen.
2. Zustandsänderung (2→3): Isentrope Kompression (adiabat und reibungsfrei)Das Gas wird isoliert und mittels mechanischer Arbeit isentrop verdichtet, dadurch auf das höhere Temperaturniveau TI gebracht.
- Q2,3 = 0
3. Zustandsänderung (3→4): Isotherme Expansion
Im Kontakt mit dem heißen Wärmereservoir expandiert das Gas bei konstanter Temperatur TI. Die zugeführte Wärmemenge wird beschrieben durch:
4. Zustandsänderung (4→1): Isentrope Expansion (adiabat und reibungsfrei)
Das Gas expandiert isentrop unter Verrichtung mechanischer Arbeit, bis der Ausgangszustand bezüglich Druck, Volumen und Temperatur wieder erreicht wird.
- Q4,1 = 0
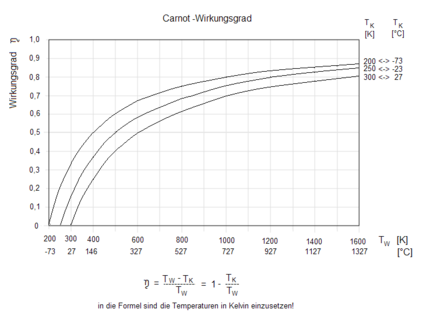
Der Wirkungsgrad
Der erste Hauptsatz der Thermodynamik lautet
Nach dem Durchlaufen des Kreisprozesses erreichen alle Zustandsgrößen im System, also auch die innere Energie ihren Ausgangswert, (ΔU = 0). Die nutzbare Arbeit berechnet sich aus:
- W = − Q.
Für den Carnot-Prozess erhält man somit:
Der Carnot-Wirkungsgrad gibt das Verhältnis von abgegebener Arbeit zur zugeführten Wärme an:
Perpetuum Mobile der zweiten Art
In allen vier Phasen des Prozesses wird mechanische Energie erzeugt beziehungsweise verbraucht. Die insgesamt gewonnene mechanische Energie nach Durchlaufen des Zyklus ist nur von der zugeführten und abgeführten Wärmemenge abhängig. Die gewonnene mechanische Arbeit entspricht der grün hinterlegten Fläche im T-S-Diagramm.
Bei Temperaturen ungleich 0 K liegt der Carnot-Wirkungsgrad immer unter 1. Das bedeutet, es gibt keine reale Maschine, die lediglich einem Reservoir Wärme entzieht und diese vollständig in Arbeit umsetzt. Eine Maschine, die bei vorgegebenen Temperaturen der Wärmereservoirs einen Wirkungsgrad größer dem Carnot-Wirkungsgrad hätte, nennt man ein Perpetuum Mobile zweiter Art. Letztendlich könnte mit der gewonnenen Arbeit wieder der Umkehrprozess als Kältemaschine durchlaufen werden, und es könnte dann eine größere Wärmemenge Q2,rev erzeugt werden als die im Wärmekraftmaschinenprozess eingesetzte.
Die Exergie ist in der Thermodynamik als der Anteil einer thermischen Energie definiert, der als Arbeit genutzt werden kann. Dem entsprechend kann der Carnot-Wirkungsgrad auch ausgedrückt werden durch:
Der nicht in Arbeit umwandelbare Anteil der thermischen Energie wird als Anergie bezeichnet.
Darstellung des Prozesses mit idealem Gas im p-V-Diagramm
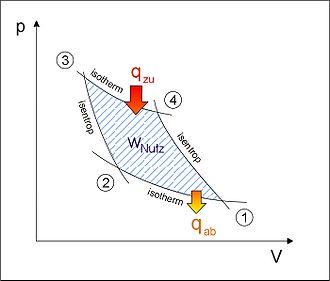 Carnot-Prozess im p-V-Diagramm mit einem idealen Gas als Arbeitsmedium
Carnot-Prozess im p-V-Diagramm mit einem idealen Gas als ArbeitsmediumIm Fall des idealen Gases als Arbeitsmedium lassen sich die spezifischen Volumenänderungsarbeiten überschaubar darstellen. Die einzelnen Arbeiten, die für Zustandsänderungen aufzubringen sind, werden hier unter der Annahme, dass sie positiv (+) sind, dargestellt und erst später bei der Bilanzierung mit dem entsprechenden Vorzeichen versehen:
- 1 - 2 : isotherme Kompression:
- 2 - 3 : isentrope Kompression, es gilt:
- 3 - 4 : isotherme Expansion
- 4 - 1 : isentrope Expansion
Arbeit des Carnot-Prozesses
Die Gesamtarbeit des Prozess ergibt sich mit der Konvention, dass aus dem System herausgehende Wärmen und Arbeiten mit negativen Vorzeichen (-) versehen werden, zu:
- mit
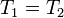 und
und 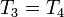 sowie der Adiabatengleichung
sowie der Adiabatengleichung 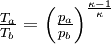 (um das Druckverhältnis p3/p4 aufzulösen) ergibt sich:
(um das Druckverhältnis p3/p4 aufzulösen) ergibt sich:
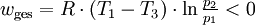
Carnot-Wirkungsgrad
Der thermische Wirkungsgrad
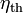 als das Verhältnis von Nutzen zu Aufwand ist demnach
als das Verhältnis von Nutzen zu Aufwand ist demnachSiehe auch
Wikimedia Foundation.