- Rubidiumiodat
-
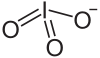
Strukturformel 
Allgemeines Name Rubidiumiodat Summenformel RbIO3 CAS-Nummer 13446-76-9 Eigenschaften Molare Masse 260,37 g·mol−1 Aggregatzustand fest
Dichte 4,33 g·cm−3[1]
Schmelzpunkt Zersetzung[1]
Löslichkeit 21 g·l−1 (23 °C)[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Rubidiumiodat ist das Rubidiumsalz der Iodsäure.
Inhaltsverzeichnis
Herstellung
Rubidiumiodat kann aus stöchiometrischen Mengen Rubidiumcarbonat und Iodsäureanhydrid hergestellt werden.[2]
Eigenschaften
Physikalische Eigenschaften
Rubidiumiodat kristallisiert im hexagonalen Kristallsystem in der Raumgruppe R3m mit den Gitterparametern a = 641.3 pm, c = 789.2 pm und 3 Formeleinheiten pro Elementarzelle.[1] In Salzsäure ist Rubidiumiodat leicht löslich unter Gelbfärbung.[1] Die Kristalle sind isomorph mit den Kristallen von Kaliumiodat.[2]
Chemische Eigenschaften
Beim Erhitzen zersetzt sich Rubidiumiodat in Rubidiumiodid und Sauerstoff:[1]
Durch Einleiten von Chlor in eine heiße konzentrierte Lösung von Rubidiumiodat und Rubidiumhydroxid entsteht Rubidiumperiodat.[2]
Rubidiumiodat reagiert mit Fluorwasserstoffsäure zu Rubidiumdifluoroiodat, das orthorhombische Kristalle bildet.[4]
Einzelnachweise
- ↑ a b c d e Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 686f. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ a b c d R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 431.Volltext
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. F. Weinland, O. Lauenstein: "Über Fluorjodate" in Zeitschr. f. Anorg. Chem. 1899, 20(1), S. 30-39. Volltext
Kategorien:- Rubidiumverbindung
- Iodat
Wikimedia Foundation.




