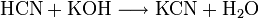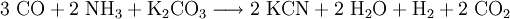- Cyankalium
-
Strukturformel 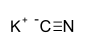
Allgemeines Name Kaliumcyanid Andere Namen - Zyankali
- Cyankalium
- Blausaures Kalium
Summenformel KCN CAS-Nummer 151-50-8 Kurzbeschreibung farblose Kristalle mit Geruch nach Bittermandeln [1] Eigenschaften Molare Masse 65,12 g·mol−1 Aggregatzustand fest
Dichte 1,553 g·cm−3 [1]
Schmelzpunkt 634,5 °C [1]
Siedepunkt 1625 °C [1]
Löslichkeit leicht löslich in Wasser (716 g·l−1 bei 25 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 26/27/28-32-50/53 S: (1/2)-7-28-29-45-60-61 MAK 5 mg·m−3 [1]
LD50 LDLo (human, peror.): 2,857 mg·kg−1 [3]
WGK 3 – stark wassergefährdend [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumcyanid (Zyankali, englisch potassium cyanide, Summenformel KCN) ist das Kaliumsalz der Blausäure (HCN).
Inhaltsverzeichnis
Eigenschaften
Kaliumcyanid bildet farblose Kristalle, die bittermandelartig riechen, einen Schmelzpunkt von 634 °C haben, sich gut in Wasser, aber nur schlecht in Alkohol lösen. Nur etwa 20–50 % der Menschen sind – aufgrund ihrer genetischen Veranlagung – in der Lage, den auf die Gefährlichkeit hinweisenden Bittermandelgeruch wahrzunehmen.
Auch mit schwachen Säuren (wie der Kohlensäure) wird aus Kaliumcyanid Blausäure freigesetzt, bei längerem Lagern bildet sich durch Aufnahme von Kohlendioxid aus der Luft Kaliumcarbonat.
Toxische Wirkung
Zyankali-Kapseln enthalten meist Kaliumcyanid oder ein anderes Salz der Blausäure (z. B. Natriumcyanid). Beim Zerbeißen und Verschlucken einer solchen Kapsel entfaltet sich die toxische Wirkung der beim Kontakt mit der Salzsäure des Magens entstehenden Blausäure (Toxische Wirkung der Blausäure). Kaliumcyanid ist eine sehr giftige Chemikalie, bereits eine eingenommene Menge von 120–250 mg wirkt in Minuten tödlich. Fische sterben bei einer Cyanidkonzentration im Wasser von 1–5 µg/l; für kleinere Säugetiere liegt die tödliche Konzentration bei einigen Milligramm pro Liter. Bei einem erwachsenen Menschen beträgt die tödliche Dosis etwa 140 mg Cyanid, dabei ist auch Hautresorption möglich. Hellrote Schleimhautblutungen weisen beim Leichnam auf Zyankali hin.
Das Cyanid-Ion blockiert die Sauerstoffbindungsstelle der Cytochrom-c-Oxidase (Komplex IV der Atmungskette), was zur inneren Erstickung führt. Vergiftungen behandelt man u. a. mit Natriumthiosulfat zur Unterstützung der hepatischen Metabolisierung, 4-Dimethylaminophenol und Hydroxycobalamin. Cyanid-Ionen werden durch das Enzym Rhodanase zu Thiocyanat-Ionen umgesetzt. Diese werden über die Niere ausgeschieden. Nach Vergiftungen kann es zu neurologischen Spätschäden kommen.
Herstellung
Die technische Herstellung erfolgt aus Blausäure und Kalilauge (Neutralisation und nachfolgendes Eindampfen).
In früherer Zeit wurde Kaliumcyanid durch Einwirken von Kohlenstoffmonoxid und Ammoniak auf Kaliumcarbonat (Pottasche) bei hohen Temperaturen hergestellt. Bei dieser von Eisen katalysierten Reaktion entstehen neben Kaliumcyanid auch Wasser, Wasserstoff und Kohlenstoffdioxid:
Im Labor wird es durch Erhitzen von Blutlaugensalzen wie Kaliumhexacyanidoferrat(III) und Schwefelsäure hergestellt. Die entstandene Blausäure wird dann mit Kalilauge neutralisiert.
Verwendung
Kaliumcyanid wird hauptsächlich zur Goldgewinnung (Cyanidlaugerei) und in galvanischen Bädern, aber auch in der organischen Synthesechemie verwendet (besonders zur Darstellung von Nitrilen).
In Form von so genannten Blausäurekapseln ist Kaliumcyanid als Mittel zur Durchführung des Suizid bekannt geworden.
Sicherheitshinweise
Es ist unbedingt zu vermeiden, dass Stäube und Dämpfe von Kaliumcyanid eingeatmet werden. Deswegen muss bei der Handhabung eine Schutzmaske getragen werden. Kaliumcyanid ist hautresorptiv. Um Berührungen mit der Haut abzuwenden, sind Gummihandschuhe und entsprechende Laborkleidung zu tragen.
Bei der Lagerung von Kaliumcyanid müssen die entsprechenden Behälter dicht geschlossen sein. Die Lagerung hat kühl und trocken und unter Verschluss zu erfolgen (Lagerklasse: 6.1BS, Nicht brennbare giftige Stoffe, fest).
Nachweis
Das klassische Analyseverfahren von Kaliumcyanid besteht im Nachweis der Cyanid-Ionen (CN−): Zur alkalischen Probelösung wird im Unterschuss Eisen(II)-sulfat-Lösung zugegeben. Sind Cyanid-Ionen vorhanden, bildet sich nach der Zugabe von Eisen(III)-Salzen Berliner Blau.
Quellen
- ↑ a b c d e f g Eintrag zu Kaliumcyanid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3.2.2008 (JavaScript erforderlich)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Blausäuresalze“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2009 (JavaScript erforderlich)
- ↑ Kaliumcyanid bei ChemIDplus
Literatur
- Römpp Chemielexikon (Hrsg. Falbe/Regitz) 9. Aufl., S. 2127 (G. Thieme, Stgt. 1995)
Weblinks
Wikimedia Foundation.