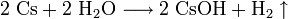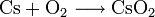- Cäsium
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Caesium, Cs, 55 Serie Alkalimetalle Gruppe, Periode, Block 1, 6, s Aussehen silberweiß glänzend, bei geringen Sauerstoffspuren goldgelb CAS-Nummer 7440-46-2 Massenanteil an der Erdhülle 6 · 10-4 % Atomar Atommasse 132,9054 u Atomradius (berechnet) 265 () pm Kovalenter Radius 225 pm Elektronenkonfiguration [Xe] 6s1 Elektronen pro Energieniveau 2, 8, 18, 18, 8, 1 Austrittsarbeit 2,1 eV 1. Ionisierungsenergie 382 kJ/mol Physikalisch Aggregatzustand fest Modifikationen 1 Kristallstruktur kubisch-raumzentriert Dichte 1,879 g/cm3 Mohshärte 0,2 Schmelzpunkt 301,60 K (28,45 °C) Siedepunkt 944,15 K (671 °C) Molares Volumen 70,94 · 10-6 m3/mol Verdampfungswärme 67,74 kJ/mol Schmelzwärme 2,092 kJ/mol Dampfdruck 1,4 · 10-4 Pa Spezifische Wärmekapazität 240 J/(kg · K) Elektrische Leitfähigkeit 4,89 · 106 A/(V · m) Wärmeleitfähigkeit 36 W/(m · K) Chemisch Oxidationszustände +1 Oxide (Basizität) Cs2O (als CsOH stark basisch) Normalpotential -2,92 V (Cs+ + e- → Cs) Elektronegativität 0,7 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 129Cs 32,06 h ε 1,195 129Xe 130Cs 29,21 min ε 2,983 130Xe β- 0,373 130Ba 131Cs 9,689 d ε 0,352 131Xe 132Cs 6,479 d ε 2,120 132Xe β- 1,280 132Ba 133Cs 100 %
Stabil 134Cs 2,0648 a β- 2,059 134Ba 135Cs 2,3 · 106 a β- 0,2 135Ba 136Cs 13,16 d β- 2,548 136Ba 137Cs 30,17 a β- 0,5 137Ba Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 11-14/15-34 S: 8-16-26-36/37/39-43-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Caesium (lat. caesius: himmelblau; wegen der charakteristischen blauen Spektrallinien, Schreibweise nach IUPAC auch Cesium), umgangssprachlich auch Cäsium oder Zäsium, ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Cs und der Ordnungszahl 55. Das extrem reaktive, goldfarbene, in hochreinem Zustand silbrig glänzende Alkalimetall schmilzt bereits bei leicht erhöhter Umgebungstemperatur.
Inhaltsverzeichnis
Geschichte
Caesium wurde erstmals 1860 zusammen mit Rubidium von dem deutschen Chemiker Robert Wilhelm Bunsen und dem deutschen Physiker Gustav Robert Kirchhoff, den Erfindern der Spektralanalyse, im Dürkheimer Mineralwasser nachgewiesen. Der Name Caesium (das Blaue) nimmt Bezug auf die typischen, im blauen Bereich liegenden Spektrallinien und wurde 1861 von Bunsen/Kirchhoff vergeben.
Im Jahr 1882 stellte Carl Setterberg erstmals metallisches Caesium durch Schmelzelektrolyse des Cyanids her.
Vorkommen
Kommerziell nutzbar ist nur das Mineral Pollucit ((Cs,Na)[(Si2Al)O6]·nH2O), welches auch Pollux genannt wird und im Bernic Lake in Manitoba, Kanada abgebaut wird. Die Herstellung des reinen Metalls erfolgt durch Reduktion von Caesiumchlorid mit Calcium.
Eigenschaften
Caesium weist von allen stabilen Elementen des Periodensystems mit 274 pm den größten Atomradius auf.
Caesium ist das weichste aller Metalle und äußerst dehnbar. Es hat nach Quecksilber und dem radioaktiven, in der Natur praktisch nicht vorhandenen Francium den drittniedrigsten Schmelzpunkt aller Metalle. Dieser liegt bei 28,45 °C, der Siedepunkt liegt bei 671 °C.
Caesium ist das reaktionsfähigste Metall, es reagiert mit vielen anderen Elementen zum Teil explosionsartig unter Feuererscheinung. Bei der äußerst heftigen, stark exothermen Reaktion mit Wasser entsteht neben Wasserstoff auch noch Caesiumhydroxid, die stärkste Metallhydroxidbase.
In Luft verbrennt Caesium mit blauvioletter Flamme zu Caesiumhyperoxid.
Oberhalb 300 °C greift es auch Glas an. Caesium ist auch das Element mit dem größten thermischen Ausdehnungskoeffizient (9,4 · 10-5 pro °C).
Isotope
Caesium hat 36 Isotope und 16 Kernisomere. Natürlich kommt nur stabiles 133Cs vor, es ist somit ein anisotopes Element oder Reinelement. Von den künstlichen Isotopen haben 134Cs mit 2,0648 Jahren, 135Cs mit 2,3 Millionen Jahren und 137Cs mit 30,17 Jahren mittlere bis sehr lange Halbwertszeiten. Die restlichen Halbwertszeiten liegen zwischen 17µs bei 113Cs und 13,16 Tagen bei 136Cs.
Die meisten Caesiumisotope entstehen als Spaltprodukte, durch Radioaktiven Zerfall anderer Spaltpodukte oder durch Neutroneneinfang von als Spaltprodukt erzeugter Cesiumisotope geringerer Massezahl im Kernreaktor.
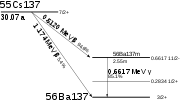
Das bedeutendste künstliche Isotop ist der Betastrahler 137Cs mit einer Halbwertszeit von 30,17 Jahren. Dieser zerfällt in 95,6 % der Fälle zuerst zum metastabilen Zwischenprodukt Barium 137mBa, das mit 2,552 Minuten Halbwertszeit durch Gammazerfall zum Stabilen 137Ba zerfällt. Bei den restlichen 5,4 % der Zerfälle zerfällt das 137Cs direkt in das stabile Bariumisotop 137Ba. Wegen der kurzen Halbwertszeit des Zwischenproduktes 137mBa wird dieses oft nicht erwähnt und 137Cs als Beta- und Gammastrahler bezeichnet.
Öffentlich bekannt wurde es insbesondere 1986 durch die radioaktive Belastung nach dem Reaktorunglück von Tschernobyl. Besonders angereichert hat es sich in bestimmten Pilzen (beispielsweise Maronenröhrlinge in Süddeutschland und Österreich) und in Wildtieren (maßgeblich Schwarzwild, in welchem sich auch heute noch bis zu 9.000 Bq/kg messen lassen (Süddeutschland, Schluchsee)). Der Grenzwert für Lebensmittel beträgt in der EU 600 Bq/kg.[2]
Ebenfalls bekannt ist das Betastrahlende 135Cs das zum stabilen 135Ba zrfällt und zu den langlebigsten Spaltprodukten gehört.
Verwendung
- Herstellung von Fotozellen (besonders für IR-Strahlung) und Photomultipliern
- Infrarotleuchtsätze zum Einsatz mit Nachtsichtgeräten .[3]
- Tarnnebelmunition [4]
- Infrarotdurchlässige Fenster, Linsen und Prismen
- Caesium-Dampf-Lampen für Nachtsichtgeräte
- Herstellung von caesiumdotierten Katalysatoren
- Atomuhren, Caesiumuhren als Zeitnormale
- Gettermetall für Vakuumröhren
- 137Cs als Strahlungsquelle für medizinische Anwendungen in der Krebstherapie und in kleinen Bestrahlungsanlagen (wie Gammacell) bei Versuchen zur Lebensmittelbestrahlung
- 137Cs als Wärmequelle in Radionuklidbatterien
- Treibstoff für Ionentriebwerke
- 137Cs als Tracer für Wind- und Wassererosion
- 137Cs als Strahlungsquelle für Dichtemessungen in der Geophysik
Nachweis
Zum Nachweis von Caesium kann man seine blaue Spektrallinie bei 455,5 nm nutzen. [5] Quantitativ lässt sich dies in der Flammenphotometrie zur Bestimmung von Caesiumspuren nutzen. In der Polarographie zeigt Caesium eine reversible kathodische Stufe bei -2,09 V (gegen SCE). Dabei müssen als Grundelektrolyt quartäre Ammoniumverbindungen (hier beispielsweise 0,1 M Tetramethylammoniumhydroxid) verwendet werden, weil andere Alkali- oder Erdalkalimetallionen sehr ähnliche Halbstufenpotentiale besitzen.[6]
Sicherheitshinweise
An Luft entzündet sich Caesium spontan, weshalb es in Ampullen unter reinem Argon oder im Vakuum aufbewahrt werden muss. In Wasser reagiert es exotherm unter Entwicklung gasförmigen Wasserstoffs. Wegen seiner hohen Reaktionsfähigkeit reagiert es mit Wasser explosiv. Die Explosivität kann durch die Entzündung des dabei entstehenden Wasserstoffs verstärkt werden.
Verbindungen
Caesium ist eines der elektropositivsten Elemente. Aufgrund des großen Elektronegativitätsunterschieds zu den meisten anderen Elementen ist es fast ausschließlich in ionischen Verbindungen anzutreffen, wie zum Beispiel:
- Caesiumhydrid (CsH)
- Caesiumhydroxid (CsOH)
- Caesiumchlorid (CsCl)
- Caesiumfluorid (CsF)
- Caesiumiodid (CsI)
Besonderheit
In gasförmigem Caesium ist die Brechzahl kleiner als 1. Das bedeutet, dass die Phasengeschwindigkeit der elektromagnetischen Welle – in diesem Fall Licht – größer als im Vakuum ist. Dieses Phänomen ist insbesondere von Plasmen her bekannt und steht in völligem Einklang mit der speziellen Relativitätstheorie, da weder Materie noch Information übertragen wird.
Siehe auch
Goiânia-Unfall – Diebstahl von Caesium-137 in den 1980-ern, das dann unter Freunden und Bekannten verteilt wurde.[7]
Einzelnachweise
- ↑ Eintrag zu Cäsium in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14. Dezember 2007 (JavaScript erforderlich)
- ↑ Landesanstalt für Umwelt, Messungen und Naturschutz Baden-Württemberg: Radioaktivitätsbelastung in Wild, 2007
- ↑ C. W. Lohkamp USP 3 733 223, The United States as represented by the Secretary of the Navy, USA, (1973)
- ↑ M. Weber DE 32 38 444, Pyrotechnische Fabrik F. Feistel GmbH & Co. KG, Göllheim, Germany, (1982)
- ↑ Greenwood, Earnshaw: Chemie der Elemente, VCH, Weinheim, 1990, S. 97.
- ↑ J. Heyrovský, J. Kůta: Grundlagen der Polarographie, Akademie-Verlag, Berlin, 1965, S. 509.
- ↑ IAEO (Hrsg.): The Radiological Accident in Goiânia. Wien 16. September 1998, ISBN 92-0-129088-8 (HTML (dort PDF) ; Stand: 2007-12-13).
Weblinks
- WebElements.com - Cesium
- EnvironmentalChemistry.com - Cesium
- Geschmolzenes Cäsium (benötigt Adobe Flash-Player)
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.

USGOV.jpg)