- Adalimumab
-
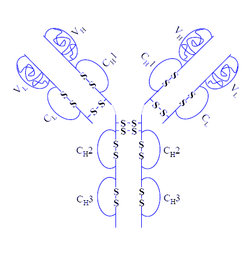
Adalimumab Masse/Länge Primärstruktur 144,2 kDa Bezeichner Externe IDs CAS-Nummer: 331731-18-1 Arzneistoffangaben ATC-Code L04AB04 DrugBank BTD00049 Wirkstoffklasse Immunsuppressivum, Monoklonaler Antikörper Verschreibungspflicht Ja Adalimumab (Handelsname Humira®; Hersteller Abbott Laboratories) ist ein therapeutischer humaner monoklonaler Antikörper gegen den Tumornekrosefaktor-α und wird daher auch als TNF-Blocker bezeichnet. Adalimumab wird zur Behandlung von rheumatoider Arthritis, Psoriasis-Arthritis, Spondylitis ankylosans und Morbus Crohn eingesetzt. Es gilt mit knapp 1.000 Euro pro Dosis[1] als eines der teuersten Medikamente auf dem deutschen Markt[2].
Inhaltsverzeichnis
Klinische Angaben
Anwendungsgebiete (Indikationen)
Adalimumab ist in der Europäischen Union[3] und der Schweiz zugelassen zur Behandlung von
- mäßiger bis schwerer rheumatoider Arthritis in Kombination mit Methotrexat, bei Unverträglichkeit gegenüber Methotrexat auch als Monotherapie,
- aktiver und progressiver Psoriasis-Arthritis bei Erwachsenen, bei denen eine Basistherapie nicht erfolgreich war,
- schwerer aktiver ankylosierenden Spondylitis bei Erwachsenen, bei denen eine konventionelle Therapie nicht erfolgreich war,
- schwergradiger, aktiver Morbus Crohn bei Patienten, bei denen eine Therapie mit einem Glukokortikoid oder einem Immunsuppressivum nicht erfolgreich war,
- Schuppenflechte vom Plaque-Typ bei Erwachsenen, die auf eine andere systemische Therapie nicht angesprochen haben.
- polyartikulärer juveniler idiopathischer Arthritis bei Kindern und Jugendlichen im Alter von 13 bis 17 Jahren in Kombination mit Methotrexat (MTX), wenn eine Therapie mit krankheitsmodifizierende Antirheumatika unzureichend war.
Art und Dauer der Anwendung
In der Regel wird bei Erwachsenen Adalimumab jede zweite Woche subkutan injiziert. Oft führen die Patienten dies nach entsprechender Einweisung selbständig durch. Ein Ansprechen der Behandlung sollte innerhalb von zwölf Wochen zu beobachten sein. In klinischen Studien wurden Patienten teilweise bis zu fünf Jahre lang mit Adalimumab behandelt.
Gegenanzeigen (Kontraindikationen)
Gegenanzeigen sind eine Überempfindlichkeit gegen Adalimumab, ferner schwere Infektionen wie aktive Tuberkulose, Sepsis und opportunistische Infektionen sowie Herzinsuffizienz. Infektionen sind deshalb so kritisch, weil aufgrund des immunsupprimierenden Wirkungsmechanismus von Adalimumab die körpereigene Abwehr gegen die Infektion geschwächt wird.
Wechselwirkungen mit anderen Medikamenten
Die Anwendung von Adalimumab in der Monotherapie ohne Methotrexat führte zu einer verminderten Wirksamkeit von Adalimumab. Bei Monotherapie ist die Wahrscheinlichkeit erhöht, dass Antikörper gegen Adalimumab gebildet werden; dadurch wird die Clearance erhöht. Bei der gleichzeitigen Anwendung von Adalimumab und Etanercept wurden schwere Infektionen beobachtet, ohne dass die Kombinationstherapie einen zusätzlichen Nutzen aufwies; deshalb wird diese Kombination nicht empfohlen.
Besondere Patientengruppen
Die Wirkungen von Adalimumab bei schwangeren Frauen sind nicht bekannt, deshalb wird die Anwendung während der Schwangerschaft nicht empfohlen. Ob Adalimumab in die Muttermilch übergeht, ist ebenfalls nicht bekannt, deshalb sollte während und bis fünf Monate nach der Behandlung nicht gestillt werden. Adalimumab wurde noch nicht bei Patienten mit Leber- oder Nierenfunktionsstörungen untersucht.
Unerwünschte Wirkungen (Nebenwirkungen)
Die häufigsten unerwünschten Wirkungen sind Reaktionen an der Einstichstelle, wie Schmerzen, Schwellungen, Rötung oder Juckreiz. Ferner können Kopfschmerzen, Schmerzen in Muskeln und Knochen, Übelkeit und Erbrechen und Hautausschläge, Veränderungen im Blutbild und erhöhte Leberenzymwerte auftreten. Da Adalimumab die Immunabwehr unterdrückt, ist das Risiko erhöht, an opportunistischen Infektionen zu erkranken, die unter Umständen einen schweren Verlauf bis hin zur Sepsis nehmen können. Es können maligne Lymphome auftreten.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Adalimumab ist ein humaner monoklonaler Antikörper vom Typ IgG1, der hoch spezifisch an das Protein Tumornekrosefaktor-alpha (TNF-α) bindet und seine Wirkung neutralisiert. TNF-α ist ein wichtiger Signalstoff des Immunsystems, der in Zellen unter anderem die Bildung von Entzündungsmediatoren auslösen kann. Bei entzündlichen Erkrankungen wie rheumatoider Arthritis liegt TNF-α in erhöhter Konzentration vor; die Neutralisierung von TNF-α durch Adalimumab führt zu einer raschen Besserung verschiedener Entzündungsparameter wie C-reaktives Protein und Interleukin-6. In placebokontrollierten Studien konnte gezeigt werden, dass Patienten nach Adalimumab-Behandlung deutlich verbessertes Ansprechen entsprechend den Kriterien des American College of Rheumatology (ACR) zeigten. Auch ein verzögertes Fortschreiten der Erkrankung und eine verbesserte Lebensqualität konnte festgestellt werden. Die Verbesserung wurde bis zu drei Jahre lang bestimmt und hielt über diesen Zeitraum an.
Arzneistoffe, die ähnlich wie Adalimumab als TNF-Antagonist wirken, sind der chimäre monoklonale Antikörper Infliximab und das Fusionsprotein Etanercept.
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Die Resorption von Adalimumab nach Injektion ist sehr langsam; die maximale Plasmakonzentration wurde nach fünf Tagen beobachtet. Die absolute Bioverfügbarkeit liegt bei 64 Prozent.
Toxikologie
Eine dosisbegrenzende Toxizität wurde während der klinischen Studien nicht beobachtet. In Tierversuchen mit Nagetieren war eine fast 2000fache Überdosis gut verträglich. In Versuchen mit Javaneraffen wurde für Adalimumab ein NOAEL von 32 mg/kg bestimmt.
Sonstige Informationen
Chemisch-pharmazeutische Informationen
Adalimumab ist ein rekombinanter humaner monoklonaler Antikörper, der in CHO-Zellen produziert wird. Der Antikörper wird mit Hilfsstoffen zu einer wässrigen Injektionslösung mit 40 mg Adalimumab in 0,8 ml Lösung verarbeitet.
Entwicklung und Vermarktung
Adalimumab wurde in Zusammenarbeit zwischen dem britischen Biotechnologieunternehmen Cambridge Antibody Technology (heute Teil von AstraZeneca) und dem Pharmaunternehmen BASF-Knoll Pharma, heute Abbott Laboratories, identifiziert und optimiert. Im Gegensatz zu vielen anderen Antikörpern wurde Adalimumab durch Phagen-Display aus einer Bank humaner Immunglobulinsequenzen identifiziert. Adalimumab ist somit ein "vollständig humaner" Antikörper. Das bedeutet, dass die kodierenden Sequenzen keine klonierten Elemente aus anderen Spezies enthalten.[4] Wegen der hohen Variabilität von Antikörpern und der Affinitätsmaturierung kommt ein therapeutischer Antikörper in Menschen praktisch nie vollkommen identisch vor. Die Markteinführung von Humira war im Dezember 2002 in den USA; die Zulassung für die Europäische Union wurde im September 2003 erteilt. Humira ist mit 2 Milliarden US-$ Jahresumsatz einer der kommerziell erfolgreichsten monoklonalen Antikörper.[5] Adalimumab wurde in der EU auch unter dem Markennamen Trudexa zugelassen, aber nie in den Verkehr gebracht. 2007 hat Abbott die Marktzulassung für Trudexa freiwillig aus kommerziellen Gründen aufgegeben.[6]
Literatur
- Singh JA, Christensen R, Wells GA, et al.: Biologics for rheumatoid arthritis: an overview of Cochrane reviews. In: Cochrane Database Syst Rev. Nr. 4, 2009, S. CD007848. doi:10.1002/14651858.CD007848.pub2. PMID 19821440.
Einzelnachweise
- ↑ http://www.docmorris.de/humira-40-mg-pen-abbott-injektionsloesung-0281795-produktdetail
- ↑ http://www.wiwo.de/unternehmen-maerkte/galerien/die-teuersten-medikamente-1055/2/humira.html
- ↑ Humira® Produktinformation, Stand: Juli 2009 auf der Website der Europäischen Arzneimittelagentur
- ↑ http://www.emea.europa.eu/humandocs/PDFs/EPAR/humira/400803en6.pdf Initial scientific discussion for the approval of Humira
- ↑ Geschäftsbericht Abbott 2006
- ↑ Rücknahme Marktzulassung Trudexa® (englisch, pdf)

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.