- Epigenetisch
-
Dieser Artikel wurde aufgrund von formalen und/oder inhaltlichen Mängeln in der Qualitätssicherung Biologie zur Verbesserung eingetragen. Dies geschieht, um die Qualität der Biologie-Artikel auf ein akzeptables Niveau zu bringen. Bitte hilf mit, diesen Artikel zu verbessern! Artikel, die nicht signifikant verbessert werden, können gegebenenfalls gelöscht werden.
Lies dazu auch die näheren Informationen in den Mindestanforderungen an Kurzartikel der Biologie.
Die Epigenetik ist ein Spezialgebiet der Biologie. Sie befasst sich mit Zelleigenschaften (Phänotyp), die auf Tochterzellen vererbt werden und nicht in der DNA-Sequenz (dem Genotyp) festgelegt sind. Hierbei erfolgen Veränderungen an den Chromosomen, wodurch Abschnitte oder ganze Chromosomen in ihrer Aktivität beeinflusst werden. Man spricht infolgedessen auch von epigenetischer Veränderung bzw. epigenetischer Prägung.[1] Die DNA-Sequenz wird dabei jedoch nicht verändert.
Einführung
Nach der Befruchtung teilt sich die Eizelle. Bis zum Stadium der Morula sind alle Tochterzellen gleich. Danach finden sich Zellen mit einem unterschiedlichen inneren Programm und jeweils eigener Funktion. Wenn der Körper fertig ausgebildet ist, sind die meisten Körperzellen für ihre Funktion fest programmiert. Dabei bleibt die Sequenz des Erbgutes unverändert (keine genetische Mutationen). Die funktionelle Festlegung erfolgt durch biochemische Ergänzungen an einzelnen Basen der Sequenz und der die DNA verpackenden Histone. Solche Veränderungen führen dazu, dass bestimmte Bereiche des Erbgutes ruhig gestellt, andere dafür leichter in RNA und Protein überführt werden können. Diese Modifizierungen finden sich nur in Körperzellen, nicht aber z. B. in Eizellen oder Spermien. Von Bedeutung für epigenetische Phänomene ist vor allem die Methylierung von Cytidin-Basen in Cytosin-Guanosin-Nukleotid-Dimeren (CpG). Außerdem spielt die Seitenketten-Methylierung und -Acetylierung von Histonen eine wichtige Rolle.
Begriffsbezeichnung
Die griechische Vorsilbe epi in Epigenetik hat mehrere Bedeutungen, wie „nach“, „hinterher“, „um herum“ oder „zusätzlich“. Epigenetisch sind danach alle Prozesse in einer Zelle, die als „zusätzlich“ zu den Inhalten und Vorgängen der Genetik gelten. Conrad Hal Waddington soll den Begriff Epigenetik erstmals benutzt haben. Im Jahr 1942 definierte er Epigenetik als „the branch of biology which studies the causal interactions between genes and their products which bring the phenotype into being“.
Epigenese
Mit dem Ausdruck Epigenese werden die graduellen Prozesse der embryonalen Morphogenese von Organen beschrieben. Diese beruhen auf epigenetischen Prozessen bei der Zellteilung der Vorläuferzellen, der Zelldifferenzierung.
Zugehörige Begriffe
Zu den epigenetischen Prozessen zählt man die Paramutation, das Bookmarking, das Imprinting, das Gen-Silencing, die X-Inaktivierung, den Positionseffekt, die Reprogrammierung, die Transvection, maternale Effekte (paternale Effekte sind selten, da wesentlich weniger nicht-genetisches Material mit dem Spermium vererbt wird), den Prozess der Karzinogenese, viele Effekte von teratogenen Substanzen, die Regulation von Histonmodifikationen und Heterochromatin sowie technische Limitierungen beim Klonen.
Epigenetik im Vergleich zur Genetik
 Funktion epigenetischer Veränderungen: Bei der Vererbung wird Erbgut weitergegeben: bei der sexuellen Vermehrung von jedem Chromosom jeweils eines (=halbes Genom). Diese fügen sich bei der Befruchtung zu einem ganzen Genom zusammen. Teilen sich Zellen, wird das Genom erst verdoppelt und dann jeweils ein ganzes Genom auf die Tochterzellen übertragen (tiefroter Hintergrund). Epigenetische Fixierung bewirkt, dass Entwicklung funktioneller Zellen nur in Richtung reife Zelle hin funktioniert, der Reifungsprozess ist normalerweise nicht umkehrbar. (Jeder Pfeil deutet eine Zellteilung an. Dabei wird die Zelle verändert. Diese Veränderungen werden mit dem Erbgut an die Tochterzellen weitergegeben. Es handelt sich dabei nicht um Sequenzveränderungen der DNA)
Funktion epigenetischer Veränderungen: Bei der Vererbung wird Erbgut weitergegeben: bei der sexuellen Vermehrung von jedem Chromosom jeweils eines (=halbes Genom). Diese fügen sich bei der Befruchtung zu einem ganzen Genom zusammen. Teilen sich Zellen, wird das Genom erst verdoppelt und dann jeweils ein ganzes Genom auf die Tochterzellen übertragen (tiefroter Hintergrund). Epigenetische Fixierung bewirkt, dass Entwicklung funktioneller Zellen nur in Richtung reife Zelle hin funktioniert, der Reifungsprozess ist normalerweise nicht umkehrbar. (Jeder Pfeil deutet eine Zellteilung an. Dabei wird die Zelle verändert. Diese Veränderungen werden mit dem Erbgut an die Tochterzellen weitergegeben. Es handelt sich dabei nicht um Sequenzveränderungen der DNA)Man kann den Begriff Epigenetik am besten verstehen, wenn man sich den Vorgang der Vererbung vor Augen führt:
- Vor einer Zellteilung wird die Erbsubstanz verdoppelt. Jeweils die Hälfte des verdoppelten Genoms wird dann auf eine der beiden Tochterzellen übertragen. Bei der sexuellen Vermehrung des Menschen, der Fortpflanzung werden von der Eizelle die Hälfte des mütterlichen Erbguts und vom Spermium die Hälfte des väterlichen Erbguts miteinander vereint.
- Die Molekulargenetik beschreibt die Erbsubstanz als Doppelhelix aus zwei Desoxyribonukleinsäure-Strängen, deren Rückgrat aus je einem Phosphat-Deoxyribosezucker-Polymer besteht. Die genetische Information ist durch die Reihenfolge der vier Basen Adenin (A), Cytosin (C), Guanin (G) und Thymin (T) bestimmt, die jeweils an einen der Deoxyribose-Zucker angehängt sind.
- Die Basen des einen Stranges paaren sich fast immer mit einer passenden Base des zweiten Stranges. Adenin paart sich mit Thymin und umgekehrt, Cytidin paart sich mit Guanosin. Für die Entwicklung des DNA-Modells haben die Forscher James D. Watson und Francis Crick im Jahre 1962 den Nobelpreis für Medizin erhalten.
- In der Reihenfolge der Bausteine A, C, G, T (der Basensequenz) ist die genetische Information verankert.
Einige Phänomene der Vererbung lassen sich nicht mit dem gerade beschriebenen DNA-Modell erklären:
- Bei der Zelldifferenzierung entstehen im Verlauf von Zellteilungen Tochterzellen mit anderer Funktion, obwohl das Erbgut in allen Zellen gleich ist. Die Festlegung der funktionellen Identität einer Zelle ist ein Thema der Epigenetik.
- Es gibt Eigenschaften, die nur vom Vater her (paternal) vererbt werden, so wie es Eigenschaften gibt, die nur von der Mutter (maternal) stammen und die nicht mit der Basensequenz in Zusammenhang stehen. Störungen dieses Zustandes führen zu schweren Krankheiten.
- Bei der Rückumwandlung von funktionell festgelegten Zellen (terminal differenzierte Zellen) in undifferenzierte Zellen, die sich wieder in verschiedene Zellen entwickeln können und die bei der Klonierung von Individuen (z. B. für von Dolly) eingesetzt werden, müssen epigenetische Fixierungen aufgehoben werden, damit eine Zelle nicht auf eine einzige Funktion festgelegt bleibt, sondern wieder alle bzw. viele Funktionen erwerben und vererben kann.
Die Methylierung der DNA
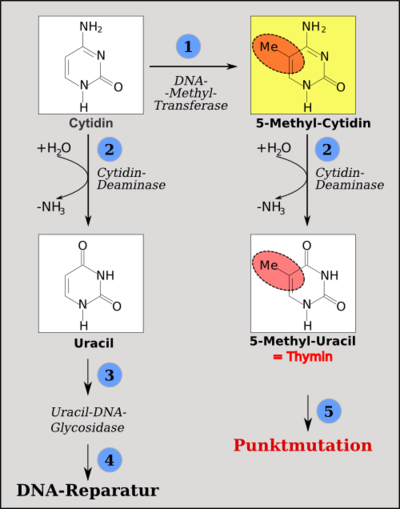 Folgen der Desaminierung: Cytidin kann durch die DNA-Methyltransferasen methyliert werden (1). Wird Cytidin desaminiert, entsteht Uracil (2). Dieses wird als DNA-fremd vom DNA-Reparatur-Apparat ausgetauscht (3). Wird Methyl-Cytidin desaminiert, entsteht Thymin (4). Dieses ist ein DNA-Baustein und die Thymin-Guanosin-Fehlpaarung wird durch Austausch von Thymin gegen Cytidin (Wiederherstellung des Ausgangszustandes) oder durch Austausch von Guanosin gegen Adenosin entfernt, was zu einer C→T-Punktmutation führt (5).
Folgen der Desaminierung: Cytidin kann durch die DNA-Methyltransferasen methyliert werden (1). Wird Cytidin desaminiert, entsteht Uracil (2). Dieses wird als DNA-fremd vom DNA-Reparatur-Apparat ausgetauscht (3). Wird Methyl-Cytidin desaminiert, entsteht Thymin (4). Dieses ist ein DNA-Baustein und die Thymin-Guanosin-Fehlpaarung wird durch Austausch von Thymin gegen Cytidin (Wiederherstellung des Ausgangszustandes) oder durch Austausch von Guanosin gegen Adenosin entfernt, was zu einer C→T-Punktmutation führt (5).Die wichtigste epigenetische Veränderung ist die Methylierung von Cytidin-Basen der DNA.[2] Dabei werden überhaupt nur solche Cytidine methyliert, die innerhalb von Cytosin-Guanosin-Dinukleotiden angetroffen werden. Andere Cytidine werden durch die bekannten menschlichen DNA-Methyltransferasen (DNMT) nicht verändert.[3]
Während der DNA-Verdopplung vor jeder Zellteilung gibt es den alten DNA-Strang, an dem bestimmte Cytidine methyliert sind, während der neugebildete DNA-Strang noch nicht methyliert ist. Das Enzym DNMT3 methyliert jedes Cytidin in einem halbmethylierten CG/CG-Paar. Eine solche CG-Methylierung führt dazu, dass Methyl-CG-erkennende Proteine an solche meCG-Paare binden. Diese Bindung führt zur Anlagerung weiterer Proteine und zur Verdichtung der Nukleosomen (siehe weiter unten). Dadurch ist die DNA an solchen meCG-Paaren für die RNA-Polymerase nicht ablesbar und das darunterliegende Gen ist inaktiv.
Methylierte Cytidin sind anfällig für Desaminierung, dabei verlieren die Cytidine die Aminogruppe an Position 6 des Ringes. Ein desaminiertes Cytidin ist ein Uracil. Dieses ist keiner der vier DNA-Bausteine Adenosin, Cytosin, Guanosin oder Thymin. Daher wird ein Uracil in der DNA als Fehler erkannt und schnellstens ausgetauscht. Wird aber ein 5-Methylcytidin desaminiert, entsteht daraus ein Thymin, das ein DNA-Baustein ist. Hier kann der DNA-Reparaturapparat nicht erkennen, ob das Thymin oder das gegenüberliegende Guanosin falsch eingebaut ist. Dass diese natürliche Mutation tatsächlich von statten gegangen ist, erkennt man daran, dass die Häufigkeit von CG-Dinukleotiden gegenüber den anderen Dinukleotid-Kombinationen stark reduziert ist.
CG-Dinukleotide treten gehäuft vor allem in den Genbereichen auf, die für die Steuerung von Genen zuständig sind, den Promotoren. Man spricht von CG-Inseln. Der Methylierungsgrad in solchen CG-Inseln ist häufig ein Maß für die Aktivität, mit der das zugehörige Gen transkribiert wird.
DNA-Methylierung bei Bakterien
Besonders bei Bakterien hat die Adenin-Methylierung eine wichtige Rolle bei der Fehlerkorrektur der frisch replizierten DNA.[4][5] Innerhalb von GATC-Tetrameren wird das Adenin an der 6-Aminogruppe methyliert (vgl. Bild rechts). Manchmal paart ein Thymin mit einem Cytidin anstelle eines Guanins und wird bei der DNA-Verdopplung irrtümlich eingebaut. Diese und andere Fehlpaarungen können von einem Komplex gefunden werden, der den DNA-Strang absucht und eine Fehlerkorrektur (proof-reading) einleitet. Hierbei wird der DNA-Strang um den Fehler herausgeschnitten, der keine methylierten Adenine aufweist. Das ausgeschnittene Stück wird schließlich neu synthetisiert.
Ist das proof-reading abgeschlossen, werden die Adenine im neuen Strang methyliert.
DNA-Methylierung bei Eukaryoten
Anders als bei Bakterien benutzt der DNA-Reparatur-Apparat der Eukaryoten nicht hemimethylierte GATC-Palindrome, um den neuen von dem alten Strang zu unterscheiden, sondern methylierte CG-Dimere. Bei C→T-Punktmutationen außerhalb von CG-Inseln kann es aber zu Irrtümern kommen, wenn das nächste CG zu weit entfernt ist. Wahrscheinlich sind deshalb die methylierten CG-Dimere nur innerhalb von CG-Inseln stabil.
CG-Methylierung spielt bei der Promotor-Inaktivierung, der Chromatin-Kondensierung, dem genomischen Imprinting und der X-Chromosom-Inaktivierung eine wichtige Rolle [6] Im Gegensatz zu Hefen, Fliegen wie Drosophila oder Nematoden wie Caenorhabditis elegans finden sich bei Pflanzen und bei den Vertebraten näher verwandten Echinodermata CH3CG-Methylierungen. .
DNA-Methyltransferasen (DNMT)
Bislang sind drei menschliche DNA-Methyltransferasen bekannt: DNMT1, DNMT3a und DNMT3b (DNMT2 methyliert RNA). Für die Erhaltungs-Methylierung (Maintenance-Methylierung) bei der Zellteilung sind DNMT3a und DNMT3b zuständig. DNMT1 methyliert die CG-Dimere, die aufgrund von Zelldifferenzierungen neu methyliert werden (de-novo-Methylierung). Mutationen im DNMT3b-Gen auf Chromosom 20 führen zum Immunschwäche/zentromere Instabilität/Gesichtsausdrucks-Anomalie-Syndrom (ICF). An methylierte DNA kann sich das Methyl-bindende Protein (MeCP) anlagern. Dieses wiederum ist Keim für weitere Proteinanlagerungen, die schließlich auch zur Modifizierung von Histonen führen. Kondensiertes Histon in Zusammenarbeit mit dem durch MeCP ausgelösten Proteinkomplex führt zur Inaktivierung eines Chromosomenabschnittes.
DNA-Methylase
Auch das Methyl-abspaltende Enzym DNA-Methylase wurde identifiziert.[7] Es war als Methyl-CpG-Domäne-bindendes Protein 2 (MBD2) schon früher beschrieben worden. Damit ist die Methylierung von DNA keine Einbahnstraße, sondern der Methylierungszustand kann zellfunktionsabhängig geregelt werden. Eine solche Situation nennt man plastisch.
Regulation der DNA-Methylierung in Tumoren
- Die Analyse der DNA-Methylierung von Tumorzellen hat ergeben, dass in Tumorzellen häufig die Gene für sogenannte Tumorsuppressorproteine im Vergleich zu Normalzellen methyliert sind.
- So ist in der akuten myeloischen Leukämie (AML) häufig die CG-Insel des P15-Proteins (auch CDKN2B oder ink4b genannt) methyliert.
- P15 ist ein hemmender Regulator des Zellzyklus.
- Nach Bildung von meCG in der CG-Insel von P15 wird dessen Transkription und die Biosynthese des P15-Proteins eingestellt.
- Beim Zellzyklus-Regulator P53 ist in 50 % aller menschlichen Tumoren das P53-Gen hypermethyliert und damit inaktiviert.[2]
- Da P53 das proof-reading kontrolliert, wird durch Ausschalten von P53 die Fehlerkontrolle aufgegeben und Mutationen können sich anhäufen, die zur Ausschaltung weiterer Tumorsuppressor-Gene oder zur Aktivierung zellwachstums-fördernder Proteine führen können.
Andererseits ist in Tumorzellen die globale DNA-Methylierung geringer als in Normalzellen. Das führt man darauf zurück, dass das in Normalzellen hochmethylierte Heterochromatin (vor allem die Zentromer-Region) in Tumorzellen geringer methyliert ist.
Seitdem man den Einfluss der Hypermethylierung auf das Tumorwachstum identifiziert hat, hat man nach Wegen gesucht, um durch Demethylierung die im Entstehen begriffenen bzw. auch schon existierende Tumore wieder der Zellzykluskontrolle zu unterwerfen:[8]
- Cytosin-ähnliche Substanzen wie Azacytosin oder Aza-Desoxy-Cytosin werden in Patienten mit Akuter Myeloischer Leukämie infundiert.
- Diese Stoffe werden in Zellen aufgenommen, deren DNA verdoppelt wird.
- Azacytosin kann in der Zelle in Aza-Desoxy-Cytosin umgewandelt werden.
- Aza-Desoxy-Cytosin wird anstelle von Cytosin in DNA eingebaut.
- Die DNA-Methylase, die die hemimethylierten CGs methylieren will, bindet an das Aza-Analog.
- Der Austausch von Kohlenstoff gegen Stickstoff bewirkt, dass das Enzym bei dem enzymatischen Methyltransfer an der DNA hängenbleibt und keine weiteren Reaktionen durchführen kann.
- Mit diesem Verfahren werden die DNA-Methylasen inaktiviert und eliminiert. Eine Methylierung findet nicht mehr statt.
- Nach der nächsten Zellteilung ist die DNA weniger methyliert. Wenn von dieser De-Methylierung z.B. das P53- oder das P15-Gen betroffen sind, findet wieder Zellzykluskontrolle statt.
- Das Tumorwachstum ist damit unterbunden.
Es wurden klinische Studien veröffentlicht, in denen bei menschlichen Patienten ein hemmender Effekt von Aza-Desoxy-Cytosin auf Tumorentwicklung gezeigt werden konnte.[9] Die Forscher nennen ihr Verfahren Epigenetische Therapie.
Für die Behandlung des Myelo-Dysplastischen Syndroms, das sich häufig zu einer Akuten Myeloischen Leukämie entwickelt, wurde 5-Aza-2'-Dexoxy-Cytosin unter dem Namen Dacogen von der FDA im Jahre 2006 als Medikament freigegeben Dacogen-Freigabe durch die FDA. Ein anderer Name für diese Substanz ist Decitabin.
Histone und ihre Rolle bei der Epigenetischen Fixierung
 Struktur eines Nukleosoms mit Histonen der Fruchtfliege: Die DNA ist um den Kern aus acht Histon-Untereinheiten (je zwei H2a,H2b,H3 und H4) gewickelt und macht etwa 1,7 Umdrehungen. (An das Stück DNA zwischen zwei Nukleosomen bindet Histon 1 (H1).) Die Enden der Histone sind für epigenetische Modifizierung verfügbar: Methylierungen, Acetylierung oder Phosphorylierung. Dadurch wird die Verdichtung oder Ausdehnung des Chromatins beeinflusst. Abbildung von Clapier et al. Proteindatenbank 2PYO[10]
Struktur eines Nukleosoms mit Histonen der Fruchtfliege: Die DNA ist um den Kern aus acht Histon-Untereinheiten (je zwei H2a,H2b,H3 und H4) gewickelt und macht etwa 1,7 Umdrehungen. (An das Stück DNA zwischen zwei Nukleosomen bindet Histon 1 (H1).) Die Enden der Histone sind für epigenetische Modifizierung verfügbar: Methylierungen, Acetylierung oder Phosphorylierung. Dadurch wird die Verdichtung oder Ausdehnung des Chromatins beeinflusst. Abbildung von Clapier et al. Proteindatenbank 2PYO[10]DNA liegt im Zellkern nicht nackt vor, sondern ist an Histone gebunden. Acht verschiedene Histonproteine, jeweils zwei Moleküle von Histon 2a, Histon 2b, Histon 3 und Histon 4 bilden den Kern eines Nukleosoms, auf das etwa 170 Basenpaare eines DNA-Stranges aufgespult sind. Die Enden der Histonstränge ragen aus dem Nukleosom heraus und sind Ziel von Histon-modifizierenden Enzymen. Vor allem Methylierungen und Acetylierungen an Lysin, Histidin oder Arginin, außerdem Phosphorylierungen an Serinen sind die bekannten Modifizierungen. Außerdem spielt eine Rolle, ob die Lysin-Seitenkette mit ein, zwei oder drei Methyl-Gruppen belegt ist. Durch vergleichende Analyse hat man einen Histon-Code entziffert, der in direktem Zusammenhang mit der Aktivität des von den Histonen jeweils gebundenen Gens steht.
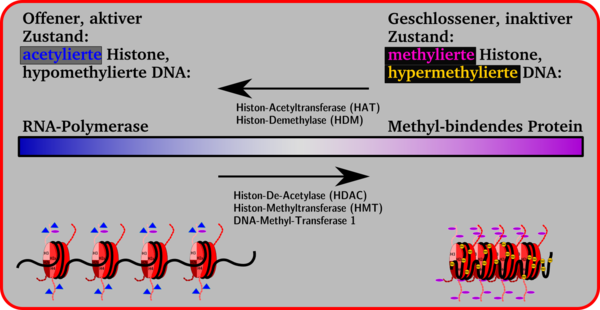 Einfluss von Methylierung und Acetylierung of die Konformation des Chromatins: Die Histonseitenketten in den Nukleosomen können enzymatisch verändert werden. Dadurch ändert sich das Volumen eines Gensegmentes. Kleinere Volumina, geschlossene Konformation, Chromosomkondensierung und Inaktivität eines Genes stehen auf der einen Seite, größere Volumina, offene Konformation Gen-Aktivität auf der anderen. Zwischen beiden Seiten ist ein Übergang möglich, der durch Anheftung und Abspaltung von Methyl-Gruppen an Cytidin-Basen, durch Methylierung, Demethylierung, Acetylierung oder Deacetylierung mit Hilfe von Enzymen bewirkt wird.
Einfluss von Methylierung und Acetylierung of die Konformation des Chromatins: Die Histonseitenketten in den Nukleosomen können enzymatisch verändert werden. Dadurch ändert sich das Volumen eines Gensegmentes. Kleinere Volumina, geschlossene Konformation, Chromosomkondensierung und Inaktivität eines Genes stehen auf der einen Seite, größere Volumina, offene Konformation Gen-Aktivität auf der anderen. Zwischen beiden Seiten ist ein Übergang möglich, der durch Anheftung und Abspaltung von Methyl-Gruppen an Cytidin-Basen, durch Methylierung, Demethylierung, Acetylierung oder Deacetylierung mit Hilfe von Enzymen bewirkt wird.Generell kann man sagen, dass Anheftung von Acetyl-Gruppen an die Lysin-Seitenketten der Histone zur Öffnung der Nukleosomen-Konformation führt, wodurch das Gen für die Transkription durch die RNA-Polymerase verfügbar wird. Durch eine verstärkte Anheftung von Methyl-Gruppen an Lysin-Seitenketten werden Proteine angeheftet wie z. B. das Methyl-bindende Protein MeCB, die die Genexpression unterdrücken, reprimieren, daher auch Repressorproteine genannt, wodurch die Histon-Konformation geschlossen wird und keine Transkription möglich ist.
Methoden der Epigenetik
Restriktionsendonukleasen, die nur an demethylierten CG-Dimeren schneiden
HpaII (Die zweite Restriktionsendonuklease aus Haemophilus parainfluenza) schneidet CCGG-Palindrome nur, wenn die CG-Dimere nicht methyliert sind, im Vergleich zu BsiSI (aus Bacillus), die auch methylierte CmeCGG-Palindrome schneidet. Tryndiak und Mitarbeiter zeigen damit, dass bei Zellen auf dem Weg zum Mammakarzinom ein fortschreitender globaler Verlust von DNA-Methylierung mit einer fehlgeleiteten Bildung der DNMT1, meCG-bindender Protein und Veränderungen in den Histonen einhergeht.[11]
Bi-Sulfit-Sequenzierung
Durch Behandlung von DNA mit Natriumhydrogensulfit (alter Name Bisulfit) werden Cytidine (C) in Uracil (U) umgewandelt. Bei einer anschließenden Sequenzierung findet man daher an den Stellen, wo vorher ein C war, nun ein U/T. Da bisulfit-behandelte DNA sehr labil ist, wird daher das Gen, das man analysieren möchte, mittels PCR wieder amplifiziert. Bei der nachfolgenden Sequenzierung werden dann T bzw. TG (Thymin-Guanosin-Dimere) identifiziert, wo in der unbehandelten DNA Cytosin bzw. CG-Dimere existierten.
Für die epigenetische Analyse ist wichtig, dass nur nicht-methylierte C-Basen konvertiert werden, während meC in CG-Dimeren nicht in Thymin konvertiert werden. Man kann daher mit dieser Methode exakt analysieren, welche CG-Dimere in einer bestimmten Zelle methyliert waren. Indem man das bisulfit-behandelte Genstück, das man analysieren möchte, nach der PCR-Amplifikation kloniert und verschiedene Klone sequenziert, erhält man ein Abschätzung, ob ein bestimmtes CG-Dimer gar nicht, vollständig oder nur partiell methyliert war. Bei der Methode des Pyrosequencing ist dieses Verfahren noch verfeinert und erlaubt genauere quantitative Aussagen: Man kann zum Beispiel den Schweregrad einer Tumorentartung mit dem Methylierungsgrad von CG-Inseln einzelner sogenannter Tumor-Suppressorproteine vergleichen und stellt fest, dass in bestimmten Tumoren des blutbildenden System (Hämatopoietisches System) bestimmte meCG-Dimere mit steigenden Schweregrad immer stärker methyliert sind.
Chromatin-Immunpräzipitierung
Bei dieser Methode kann man bestimmen, ob ein bestimmtes Proteine an ein gegebenes DNA-Stück bindet: Durch Behandlung mit Formaldehyd werden die bindenden Proteine mit der DNA chemisch verknüpft. Durch Behandlung mit Ultraschall wird die DNA dann in Bruchstücke von 50 bis 1000 Basenpaare fragmentiert mit den gebundenen Proteinen an der DNA hängend. In einem nächsten Schritt werden mit Antikörpern gegen das bindende Proteine die an ein Protein gebundenen Gene gefischt. Nach der Auftrennung der chemischen Verknüpfung durch Hitzebehandlung in 300 mM Kochsalz-Lösung kann man mit einer PCR das interessierende Genstück amplifizieren und schließlich bestimmen, ob eine Amplifikation stattgefunden hat oder nicht. Im ersteren Fall war das Protein an das Gen assoziiert, im zweiten Fall nicht. Je nach dem, welches Protein man mit Antikörpern versucht zu fischen, kann man z. B. sagen:
- die RNA-Polymerase hat an dem Gen gebunden, daher wurde es transkribiert, das Gen war aktiv
- das meCG-bindene Protein (MeCP) war an das Gen gebunden, daher wurde dieses nicht transkribiert und war ruhig gestellt (silencing)
Gelshift-Versuche
(noch Baustelle)
Vererbung epigenetischer Prägungen
Die Vererbung epigenetischer Prägungen von einer Generation zur anderen Generation ist nur in ganz wenigen Fällen möglich. So könnten epigenetische Veränderungen bei Pigmenten der Maispflanze bzw. der Tomate erfolgen. Häufig wird der Begriff „Generation“ als Beginn eines Individualzyklus aber falsch interpretiert.
Die sicheren Befunde über genetische Veränderungen können den Lamarckismus argumentativ nicht unterstützen. Bisher wurde kein Beweis erbracht, dass erlernte und erworbene Fähigkeiten von einer Generation zur anderen vererbt werden könnten.
Einzelnachweise
- ↑ Rudolf Hagemann: Epigenetik und Lamarckismus haben nichts gemeinsam! In: Laborjournal 4/2009; S. 12
- ↑ a b Jeltsch, A. (2002): Beyond Watson and Crick: DNA methylation and molecular enzymology of DNA methyltransferases. In: ChemBioChem 3(4); 274–293; PMID 11933228
- ↑ Jeltsch, A. (2006): Molecular enzymology of mammalian DNA methyltransferases. In: Curr Top Microbiol Immunol. 301; 203–225; PMID 16570849
- ↑ Barras, F. und Marinus, MG. (1989): The great GATC: DNA methylation in E. coli. In: Trends Genet. 5(5); 139–143; PMID 2667217
- ↑ Marinus, MG. und Casadesus, J. (2009): Roles of DNA adenine methylation in host-pathogen interactions: mismatch repair, transcriptional regulation, and more. In: FEMS Microbiol Rev. 33(3); 488–503; PMID 19175412; doi:10.1111/j.1574-6976.2008.00159.x
- ↑ Mathieu, O. et al. (2002): Methylation of a euchromatin-heterochromatin transition region in Arabidopsis thaliana chromosome 5 left arm. In: Chromosome Research 10(6); 455–466; PMID 12489828; doi:10.1023/A:1020936229771
- ↑ Cervoni, N. et al. (1999): DNA demethylase is a processive enzyme. In: J. Biol Chem. 274(13); 8363–8366; PMID 10085064; PDF (freier Volltextzugriff, engl)
- ↑ Momparler, RL. und Bovenzi, V. (2000): DNA methylation and cancer. In: J. Cell Physiol. 183(2); 145–154; PMID 10737890
- ↑ Wijermans, PV. et al. (2005): An epigenetic approach to the treatment of advanced MDS; the experience with the DNA demethylating agent 5-aza-2'-deoxycytidine (decitabine) in 177 patients. In: Ann. Hematol. 84(Suppl1); 9–17; PMID 16211386; doi:0.1007/s00277-005-0012-1
- ↑ Clapier, CR. et al. (2007): Structure of the Drosophila nucleosome core particle highlights evolutionary constraints on the H2A-H2B histone dimer. In: Proteins 71(1); 1–7]; PMID 17957772; PDF (freier Volltextzugriff, engl.)
- ↑ Tryndiak, VP. et al. (2006): Loss of DNA methylation and histone H4 lysine 20 trimethylation in human breast cancer cells is associated with aberrant expression of DNA methyltransferase 1, Suv4-20H2 histone methyltransferase and methyl-binding proteins. In: Cancer Biol Ther. 5(1), 65–70; PMID 16322686; PDF (freier Volltextzugriff, engl.)
Übersichtsartikel
- Bradbury, J. (2003): Human Epigenome Project—Up and Running. In: PLoS Biol. 1:e82 doi:10.1371/journal.pbio.0000082; PDF (freier Volltextzugriff, engl.)
- Costa, FF. (2008): Non-coding RNAs, epigenetics and complexity. In: Gene 410(1); 9–17; PMID 18226475; doi:10.1016/j.gene.2007.12.008
- Jablonka, E. und Lamb, MJ. (2002): The Changing Concept of Epigenetics. In: Annals of the New York Academy of Sciences 981:82–96; PMID 12547675;
- Delcuve, GP. et al. (2009): Epigenetic control. In: J Cell Physiol. 219(2); 243–250; PMID 19127539; PDF (freier Volltextzugriff, engl.)
- Marmorstein, R. und Trievel, RC. (2009): Histone modifying enzymes: structures, mechanisms, and specificities. In: Biochim Biophys Acta 1789(1); 58–68; PMID 1872256; doi:10.1016/j.bbagrm.2008.07.009
- Morgan, HD. et al. (2005): Epigenetic reprogramming in mammals. In: Hum Mol Genet. 14 Spec No 1; R47–58; PMID 15809273; PDF (freier Volltextzugriff, engl.)
Nachschlagewerke
- Oscar Hertwig (1849-1922): Biological problem of today: preformation or epigenesis? The basis of a theory of organic development. W. Heinemann: London, 1896.
- Joachim Bauer: Das Gedächtnis des Körpers: wie Beziehungen und Lebensstile unsere Gene steuern. Frankfurt a.M.: Eichborn, 2002. Erweiterte Taschenbuchausgabe München: Piper, 2004 (10. Aufl. 2007). ISBN 978-3-492-24179-3
- Wolfgang Wieser: Gehirn und Genom: ein neues Drehbuch für die Evolution. München: C.H. Beck, 2007 ISBN 3406556345
Weblinks
- The Epigenome Network of Excellence (enthält Verweise auf aktuelle Veröffentlichungen) (engl.)
- Epigenetische Vererbung - die Rehabilitierung von Lamarck
- wissenschaft.de: Epigenetik - Vererbung ist mehr als die Summe der Gene
- Deutschlandfunk - Wie die Epigenetik die Biologie revolutioniert
- Spiegel Online: Bruch des bösen Zaubers - Wie Kindheitserfahrungen Spuren im Erbgut hinterlassen (Epigenetik)
Wikimedia Foundation.