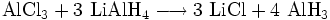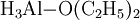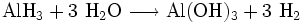- AlH3
-
Kristallstruktur 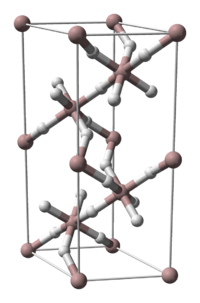
Allgemeines Name Aluminiumhydrid Andere Namen - Alan
- Aluminiumwasserstoff
Verhältnisformel (AlH3)x CAS-Nummer 7784-21-6 Kurzbeschreibung Farbloses Pulver Eigenschaften Molare Masse 30,0 g·mol−1 Aggregatzustand fest
Dichte 1,477 g·cm−3[1]
Schmelzpunkt Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Aluminiumhydrid, Summenformel (AlH3)x, ist ein farbloses Pulver, welches oberhalb von 100 °C in seine Bestandteile zerfällt. Aluminiumhydrid ist außerordentlich feuchtigkeits- und oxidationsempfindlich. Es verbrennt explosionsartig an Luft und kann zur Speicherung von Wasserstoff in wasserstoffbetriebenen Fahrzeugen eingesetzt werden.
Inhaltsverzeichnis
Eigenschaften
Von Aluminiumhydrid kennt man fünf kristalline Phasen (α, γ, δ, ζ), von denen bislang nur die Struktur der α-Phase erforscht wurde. Durch Einbau von 0,01 bis 3 Gewichtsprozent Magnesium kann die Vakuumstabilität von α-Aluminiumhydrid signifikant erhöht werden.[3] Auch kann die Beständigkeit gegenüber Hydrolyse durch Tempern erhöht werden.[4] So behandeltes α-Aluminiumhydrid wird zur Zeit intensiv als energetischer Zusatz für Raketentreibstoffe und Sprengstoffe untersucht.[5]
Synthese
Die Darstellung von Aluminiumhydrid erfolgt zweckmäßig durch die Umsetzung von Aluminiumchlorid mit Lithiumalanat:
Hierbei wird zunächst eine als Monomer anfallende Verbindung, das Etherat:
gebildet, welche sich allmählich in das hochpolymere Aluminiumhydrid umwandelt.
Reaktionsverhalten
Aluminiumhydrid reagiert mit Wasser sehr stark unter Wasserstoff-Freisetzung gemäß:
Zusammen mit anderen Metallhydriden bildet Aluminiumhydrid Alanate
Quellen
- ↑ a b Holleman/Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ N. E: Matzek, H. C. Roehrs, US Patent 3 857 922, 1975, Stabilisation of light metal hydride
- ↑ A. N. Golubkov, RU Patent 2 175 637, Method of increasing thermal stability of aluminium hydride
- ↑ [1]V. Weiser, N. Eisenreich, A. Koleczko, E. Roth, On the Oxidation and Combustion of AlH3 a Potential Fuel for Rocket Propellants and Gas Generators, Prop., Explos., Pyrotech. 32 2007 213.
Wikimedia Foundation.