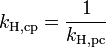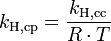- Henrysches Gesetz
-
Das Henry-Gesetz (nach dem englischen Chemiker William Henry) beschreibt das Löslichkeitsverhalten von (flüchtigen) Substanzen in einer Flüssigkeit.
Inhaltsverzeichnis
Definition
Es besagt, dass die Konzentration eines Gases in einer Flüssigkeit direkt proportional zum Partialdruck des entsprechenden Gases über der Flüssigkeit ist. Die Proportionalität wird durch die Henry-Konstante ausgedrückt. Die am häufigsten verwendete Schreibweise ist:
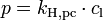
- (p: Partialdruck der Substanz, cl: Konzentration in der Lösung, kH,pc: Henry-Konstante)
Es ist mit dem Prinzip von Le Châtelier vereinbar, denn auf eine äußere Druckzunahme wird das System mit einer Verkleinerung der Gasteilchenanzahl reagieren (und den Druck somit wieder vermindern, bzw. dem „Zwang“ ausweichen).
Verschiedene Versionen
Verschiedene Versionen des Henry-Gesetzes Gleichung: 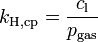
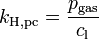
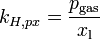
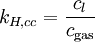
andere Namen für k: λ – – L Dimension: ![\left[\frac{\mathrm{mol}_\mathrm{gas}}{\mathrm{l} \cdot \mathrm{atm}}\right]](/pictures/dewiki/97/afa6b86103eb8211cd3374e338c1f1fc.png)
![\left[\frac{\mathrm{l} \cdot \mathrm{atm}}{\mathrm{mol}_\mathrm{gas}}\right]](/pictures/dewiki/57/9ffe3a0529943c7f016acfa5c55daa6e.png)
![\left[\frac{\mathrm{atm} \cdot \mathrm{mol}_\mathrm{wasser}}{\mathrm{mol}_\mathrm{gas}}\right]](/pictures/dewiki/100/dca65474f522b93939644df3899098fa.png)
![\left[ \text{dimensionslos} \right]](/pictures/dewiki/51/31a7ab9fb6d6b226ad00ad7243f78dec.png)
Die verschiedenen Henry-Konstanten lassen sich ineinander umrechnen, beispielsweise ergibt sich für
oder
wobei R die molare Gaskonstante ist und T die Temperatur des Systems.
Grenzen der Gültigkeit
Strenggenommen ist das Henry Gesetz nur für kleine und mäßige Drücke bis ungefähr 5 Bar anwendbar. Auch ist es nur bei verdünnten Lösungen gültig, das heißt bei niedrigen Partialdrücken. Zudem darf das gelöste Teilchen nicht mit dem Lösungsmittel reagieren, wie zum Beispiel Kohlenstoffdioxid, welches zu Kohlensäure reagiert und dem Gleichgewicht entzogen wird.
Anwendung im Tauchsport
Mit dem relativ einfachen Henry-Gesetz lässt sich die Dekompressionserkrankung bei Tauchern erklären. Der Umgebungsdruck nimmt um etwa 1 bar pro 10 Meter Wassertiefe zu. Da dem Taucher die Atemluft parallel zum tiefenabhängig steigenden Wasserdruck mit steigendem Flaschendruck zugeführt wird (-und damit der Einatemvorgang erleichtert bzw., in größeren Tiefen, überhaupt erst ermöglicht wird-), löst sich der in der zugeführten Atemluft enthaltene Stickstoff bei steigendem Partialdruck zunehmend besser im Blut. Taucht der Taucher jedoch zu schnell wieder auf, nimmt die Löslichkeit des Gases im Blut gemäß dem Henry-Gesetz rapide ab und der Stickstoff gast aus. Die entstehenden Gasbläschen behindern die Blutströmung und führen zur Dekompressionserkrankung.
Weblinks
- Umfassende Liste von Henry-Konstanten, Einheiten-Umrechnungstool
- Das Gesetz von Henry auf den Seiten von www.tauchersprechstunde.de
Wikimedia Foundation.