- Kjeldahl-Aufschluss
-
Die Kjeldahlsche Stickstoffbestimmung ist eine 1883 entwickelte quantitative, häufig verwendete Bestimmungsmethode des Stickstoffgehaltes. Die Methode wurde nach dem dänischen Chemiker Johan Kjeldahl – Mitarbeiter einer noch heute produzierenden dänischen Brauerei – benannt. Der Stickstoff kann in vielen verschiedenen stickstoffhaltigen Substanzen bestimmt werden, was sich im breiten Anwendungsfeld der Methode äußert:
- Nahrungsmittelindustrie
- Umweltanalytik
- Pharmazeutische und chemische Industrie
- Landwirtschaftliche Analytik (Wirtschaftsdünger, Bodenproben)
Beim klassischen Vorgehen wird eine genau gewogene Probemenge (0,5 bis 3 g, abhängig vom Stickstoffgehalt der Probe) mit Schwefelsäure in einem Kjeldahl-Kolben aufgeschlossen. Die organischen Anteile einer Probe werden so entfernt und der Stickstoff der Probe dabei in Ammoniumsulfat umgewandelt. Mit der Zugabe einer starken Base wird Ammoniak aus der Aufschlusslösung freigesetzt, welcher in einer Säure aufgefangen und titrimetrisch bestimmt wird.
Es existieren auch Mikro-Methoden für 5–15-mg-Proben.
Zudem lässt sich die gesamte Bestimmung mittels vollautomatischer Laborgeräte – auch mit mehreren Proben gleichzeitig – automatisieren, so dass die Analysen auch ohne anwesendes Personal über Nacht abgewickelt werden können.
Inhaltsverzeichnis
Aufschluss
Beim Aufschluss wird die Probe mit einem Überschuss an Schwefelsäure in einem offenen Kolben gekocht. Dabei wird der Kohlenstoff im organischen Material zu CO2 oxidiert und Schwefelsäure zu SO2 reduziert:
Zur verbesserten Umsetzung der Reaktion wird ein Katalysator, bestehend aus Hg-, Se-, Cu- oder Ti-Verbindungen, verwendet. Dieser reduziert die Aktivierungsenergie. Die Aufschlusstemperatur in einem offenen Kolben ist durch den Siedepunkt der Schwefelsäure begrenzt. Wird eine schwerflüchtige Verbindung hinzugegeben, so sinkt der Dampfdruck der Lösung. Damit der Dampfdruck den Betrag des Atmosphäredruckes erreicht, muss nun eine höhere Temperatur vorliegen, die Lösung siedet bei höherer Temperatur. Beim Kjeldahlaufschluss erhöhen Natrium- oder Kaliumsulfat (K2SO4) den Siedepunkt.
Es können nicht alle Substanzen direkt aufgeschlossen werden. Liegt der Stickstoff in einer Nitro-, Nitroso-, oder Azoverbindung vor, so muss zuerst eine Reduktion (beispielsweise mit Zink oder Devardscher Legierung) durchgeführt werden.
Der Schwefelsäureaufschluss kann neben der Bestimmung von Stickstoff auch zur Bestimmung von Phosphor, Arsen und von Metallen in organischem Material verwendet werden.
Wasserdampfdestillation
Nach dem Aufschluss liegt der Stickstoff als Ammoniumsulfat (NH4)2SO4 in Schwefelsäure gelöst vor. Bei Zugabe einer starken Base (beispielsweise NaOH) wird die Schwefelsäure neutralisiert und Ammoniak ausgetrieben, welcher mittels Wasserdampfdestillation quantitativ in eine Säurevorlage eingeleitet werden kann.
Zum Auffangen kann prinzipiell jede Säure verwendet werden. Wird eine starke Säure verwendet, so muss diese genau abgemessen werden, da die nach dem Einleiten von Ammoniak verbleibende Säure mit einer Base fertig titriert wird. Wird hingegen eine schwache Säure verwendet (beispielsweise Borsäure), so kann die beim Auffangen entstandene starke Base mit einer Säure titriert werden, ohne dass überschüssige Auffangsäure mit erfasst wird. Dies bringt den Vorteil, dass die schwache Säure nicht genau abgemessen werden muss.
Titration
Für die direkte Titration von Borat wird ein Indikatorgemisch aus Methylrot und Methylenblau (Tashiro) verwendet, welches im Saueren umschlägt. Das verbrauchte Maßlösungsvolumen kann in die Stickstoffmenge der Probe umgerechnet werden.
Eine andere Methode ist die Formol-Titration.
Proteingehalt
Aus dem Stickstoffgehalt eines Lebensmittels kann dessen Proteingehalt berechnet werden. Proteine sind Polymere aus Aminosäurebausteinen. Die Primärstruktur legt die Abfolge der Aminosäurebausteine für jedes Protein fest. Bei einem Lebensmittel liegt eine Vielzahl von verschiedenen Proteinen vor, die also ihrerseits wieder unterschiedlich aussehen. Es ist somit nicht unter vernünftigem Aufwand möglich, den Stickstoffgehalt eines Lebensmittels zu errechnen. Stattdessen gibt es eine einfachere Möglichkeit: Die Proteine werden in die einzelnen Aminosäuren zerlegt und deren Menge gemessen. Über die Struktur der einzelnen Aminosäuren kann nun der Stickstoffanteil der Gesamtmenge der Proteine berechnet werden. Die so gefundenen Stickstoffanteile im Protein bewegen sich um 16 %. Der Stickstoffgehalt einer Probe muss mit dem Faktor 6,25 multipliziert werden, was zu einem Näherungswert führt. Bei Weizenmehlen, Grieß und Dunst beträgt der Faktor 5,7.
Die Grenzen dieses Verfahrens zeigt zum Beispiel der Melamin-Skandal 2008 in China: Streckung von Milchprodukten, um bei gebräuchlichen Messverfahren einen höheren Proteingehalt vorzutäuschen.
Literatur
- Hoegger R.: Training Papers Nitrogen determination according to Kjeldahl; Büchi Labortechnik AG, Flawil, 1998, pp 1-18
- Bock R: Aufschlussmethoden der anorganischen und organischen Chemie; Verlag Chemie, Weinheim, 1972, pp142-145
Wikimedia Foundation.


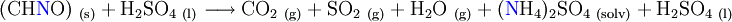
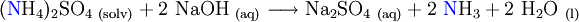
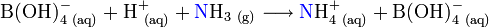
![\mathrm{{\color{Blue}N}H_{4 \ (aq)}^+ + B(OH)_{4 \ (aq)}^- + HCl_{ \ (aq)} \longrightarrow {\color{Blue}N}H_4Cl_{ \ (aq)} + H[B(OH)_4]_{ \ (aq)}}](/pictures/dewiki/55/7fad8af02477c217b798cc6e7b62b6f7.png)