- Nassdampf
-
 Siedendes Wasser, Dampfblasen und teilkondensierter Wasserdampf
Siedendes Wasser, Dampfblasen und teilkondensierter Wasserdampf
In der Umgangssprache versteht man unter Wasserdampf meist die sichtbaren Dampfschwaden von teilweise bereits kondensierendem Wasserdampf (Nassdampf), wie er auch als Nebel oder in Wolken vorkommt.Im technisch-naturwissenschaftlichen Kontext ist Wasserdampf gasförmiges Wasser, das in diesem Aggregatzustand unsichtbar ist wie Luft. Jedoch wird auch in diesem Zusammenhang von Wasserdampf und nicht von Wassergas gesprochen, da letzterer Begriff anders belegt ist.
Entstehung und Zustände
Bei einem normalen Umgebungsdruck von 1,013 bar (101,325 kPa) siedet Wasser bei 100° Celsius. Wird dem verbliebenen Wasser darüber hinaus Energie (Wärme) zugeführt, verdampft es, ohne dass es zu einem weiteren Temperaturanstieg kommt. Aus 1 Liter (entsprechend 1 kg) Wasser entstehen 1,673 m³ Wasserdampf, wofür eine Energiezufuhr von 2.257 kJ benötigt wird.
Die zugeführte Energie erhöht die innere Energie des Dampfes um 2.088 kJ und leistet gegenüber dem Umgebungsdruck eine Volumenänderungsarbeit W.
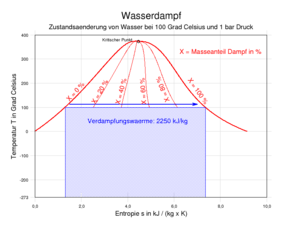
Beide Beiträge ergeben addiert die Verdampfungsenthalpie H, die sich in einem Enthalpie-Entropie-Diagramm (h-s-Diagramm) in Form einer Differenz auf der y-Achse als spezifische Größe ablesen lässt. Das hier abgebildete T-s-Diagramm stellt die für die Verdampfung (bei 100 °C) notwendige Wärme in Form der gepunkteten blauen Fläche dar.
Ebenso lässt sich dabei der Zuwachs an Verdampfungsentropie ΔS (Delta S) ermitteln:
QH = Verdampfungswärme bzw. Verdampfungsenthalpie
T = Siedetemperatur in K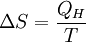
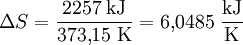
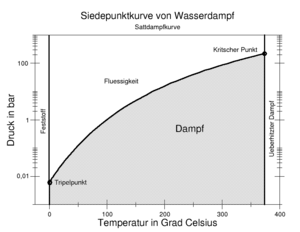
Entsprechend dem Phasendiagramm siedet Wasser bei einem Luftdruck von 0,4 bar, wie er beispielsweise auf dem Mount Everest gegeben ist, schon bei etwa 75 °C. Die aufzuwendende Verdampfungswärme ist jedoch größer, ebenso die Volumenzunahme des Dampfes. Mit steigendem Druck nimmt die Verdampfungswärme des Wassers entsprechend den kleiner werdenden Flächen im T-s-Diagramm ab, bis sie im kritischen Punkt gleich Null ist.Erscheinungsformen
Der Dampfdruck des Wassers ist temperaturabhängig. Bei Temperaturen unterhalb des Siedepunktes spricht man von Verdunstung. In gesättigter Umgebungsluft stellt sich ein Gleichgewicht zwischen verdunstendem Wasser und kondensierendem Wasserdampf ein.
Die Übergangsbedingungen zwischen flüssigem Wasser und Wasserdampf sind in der Siedepunktkurve des Zustandsdiagramms dargestellt, welche in der rechten Abbildung dargestellt ist.
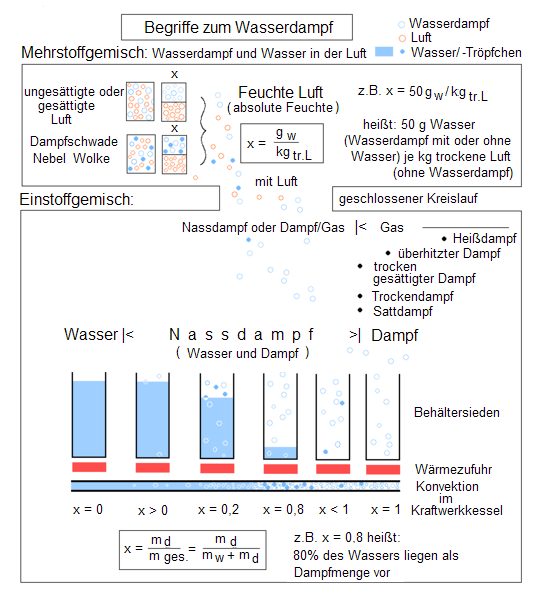
Nassdampf
Wenn Wasser in einer kälteren Umgebung unter Zufuhr von Wärme verdampft, kondensieren Teile des gasförmigen Wassers wieder zu feinsten Tröpfchen. Der Wasserdampf besteht dann aus diesen und gasförmigem, unsichtbarem Wasser. Diese Mischung bezeichnet man als Nassdampf, der zum Beispiel beim Wasserkochen sichtbar wird. Im T-s-Diagramm erstreckt sich der Bereich des Nassdampfes bis zum kritischen Punkt bei 374 °C und 221,2 bar.
Der Inhalt des Nassdampfes an flüssigem Wasser ist durch den Massenanteil x gekennzeichnet, der sich mit folgender Formel berechnen lässt:
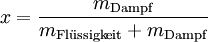
Heißdampf
Überhitzter Dampf
- → Hauptartikel: Heißdampf, Überhitzer
Überhitzter Dampf ist Dampf mit einer Temperatur oberhalb der Siedetemperatur. Der Dampf ist "trocken" und enthält keine Tröpfchen. In Dampfkesseln wird der erzeugte Dampf mittels des Überhitzers in diesen Zustand gebracht.
Überkritischer Dampf
Oberhalb des kritischen Punktes sind Wasserdampf und flüssiges Wasser in ihrer Dichte nicht mehr voneinander zu unterscheiden, weshalb dieser Zustand als „überkritisch“ bezeichnet wird. Überkritisches Wasser hat chemisch gesehen besonders aggressive Eigenschaften. Es wurden daher Versuche unternommen, mit dessen Hilfe biologisch schwer abbaubare organische Schadstoffe, wie z. B. Dioxine, PCB etc., hydrolytisch zu spalten. Unterhalb des kritischen Punktes ist der Wasserdampf folglich „unterkritisch“, wobei er sich in einem Gleichgewicht mit dem flüssigen Wasser befindet. Wird er in diesem Bereich nach dem vollständigen Verdampfen der Flüssigkeit über die zugehörige Verdampfungstemperatur weiter erwärmt, so entsteht „überhitzter Dampf“. Diese Form des Dampfes enthält keine Wassertröpfchen mehr und ist in ihrem physikalischen Verhalten ebenfalls ein Gas und nicht sichtbar.
Sattdampf oder trocken gesättigter Dampf
Der Grenzbereich zwischen Nass- und Heißdampf heißt „Sattdampf“, auch gesättigter Dampf oder trocken gesättigter Dampf, gelegentlich in Abgrenzung zum Nassdampf auch „Trockendampf“. Auf diesen Zustand sind die meisten Tabellenwerte über Wasserdampf bezogen.
x = 0 und x = 1
Eine besondere Bedeutung kommt den beiden Grenzkurven x = 0 und x = 1 im T-s-Diagramm zu, die sich im kritischen Punkt treffen: Die Kurve x = 0 grenzt das Gebiet der Flüssigkeit vom Nassdampf ab, während die Kurve x = 1 den Nassdampf vom Heißdampf trennt und gleichzeitig den Zustand des Sattdampfes markiert. Andere Bezeichnungen für die Kurve x = 0 sind Siedelinie oder untere Grenzlinie, die Kurve x = 1 wird auch Taulinie, Sattdampfkurve oder obere Grenzlinie genannt. Die Schreibweise mit x für den Massenbruch ist hierbei nicht einheitlich definiert, da vor allem in der Chemie der Massenanteil mit w angegeben wird und x hier mehrheitlich für den Stoffmengenanteil steht. Da beide Größen ineinander umrechenbar sind und sich in den Grenzwerten 0 und 1 gleichen, spielt dies hier eine untergeordnete Rolle.
Erscheinung
Gasförmiger oder überhitzter Wasserdampf ist farblos und damit unsichtbar, wie die meisten Gase. Nassdampf ist durch die mitgerissenen Wassertropfen dagegen sichtbar. Bei Kontakt mit hinreichend kühler Umgebungsluft kommt es zur Unterschreitung des Taupunktes und folglich zu einer Kondensation weiterer feinster Wassertropfen. An ihnen wird Licht gestreut, so dass dadurch die Existenz des Wasserdampfs in der Luft sichtbar wird.
Wasserdampf kann auch direkt, ohne den Umweg über die Flüssigkeit, aus der festen Phase von Wasser entstehen: Aus Eis oder Schnee. Dieses Phänomen kann in der Natur bei extrem trockener Luft im Hochgebirge beobachtet werden, wenn verschneite Hänge bei Temperaturen von weit unter 0 °C mit der Zeit schneefrei werden. Hierbei entsteht der Wasserdampf durch Sublimation: Die Luftfeuchte nimmt durch Abdampfen aus dem Schnee zu, und zuvor verschneite Flächen apern aus, ein bekanntes Phänomen z. B. im Himalaya. Aus denselben Ursachen trocknet im Freien aufgehängte Wäsche auch, wenn es friert.
Das Bild zeigt, wie in der Luft unsichtbar vorhandener Wasserdampf unter besonderen Bedingungen kondensiert und damit sichtbar wird, z. B. wenn ein Flugzeug in Bodennähe mit Überschallgeschwindigkeit fliegt (oft falsch bezeichnet mit "die Schallmauer durchbricht"). Der Wasserdampf im heißen Abgas wird hingegen von der sich erwärmenden Luft aufgenommen.
Sieden
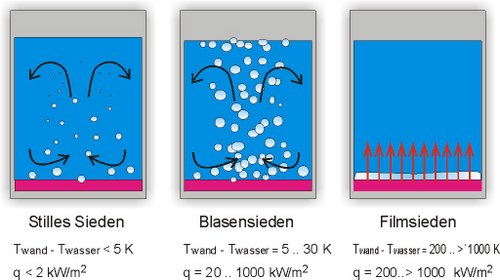
In Abhängigkeit von der Wärmestromdichte, die der siedenden Flüssigkeit über eine Heizfläche zugeführt wird, bilden sich unterschiedliche Siedeformen aus.
Wenn die Temperatur der Heizfläche über der Siedetemperatur liegt, bilden sich an Riefen oder Kratzern Blasenkeime. Bis zu Wärmestromdichten von 2 kW/m2 bilden sich Blasen, die beim Hinaufsteigen wieder kondensieren. Diese Siedeform wird als stilles Sieden bezeichnet. Die Oberflächentemperatur der Heizfläche liegt einige Grad über der Siedetemperatur.
Mit steigender Wärmestromdichte nimmt die Blasenbildung zu, und die Blasen erreichen die Oberfläche. Die an den Heizflächen abreißenden Blasen führen zu einem hohen Wärmeübergangskoeffizienten. Die Wandtemperaturen steigen nicht wesentlich über die Siedetemperatur (bis etwa 30 K). Beim Blasensieden können Wärmestromdichten bis 1000 kW/m2 erreicht werden. Wird die Wärmestromdichte dann noch weiter gesteigert, setzt sprunghaft das Filmsieden ein: Es bildet sich ein durchgehender Dampffilm. Dieser wirkt wie eine Isolierschicht, und der Wärmeübergangskoeffizient wird drastisch reduziert. Wird der Wärmestrom nicht reduziert, so wird erst dann wieder ein Gleichgewichtszustand erreicht, wenn die Wärme durch ausreichend hohe Wärmestrahlung abgegeben werden kann. Dieser Zustand wird aber erst bei einer Überhitzung der Heizfläche von ca. 1000 K erreicht. In der Regel wird bei diesem Übergang vom Blasensieden zum Filmsieden die Heizfläche zerstört.
Um einer Zerstörung von Heizflächen an Dampfkesseln vorzubeugen, wird die maximale Wärmestromdichte auf 300 kW/m2 begrenzt.
Tabellen, Diagramme und Formeln
Wegen seiner enormen Bedeutung für die Energiewirtschaft zählt Wasserdampf zu den am besten erforschten Stoffen innerhalb der Thermodynamik. Seine physikalischen Eigenschaften wurden durch Messungen und Berechnungen bestimmt und in umfangreichen Tabellenwerken, den so genannten Wasserdampftafeln [1], erfasst.
T-s-Diagramm
 Entropie-Temperatur-Diagramm von Wasserdampf (1 MPa = 10 bar)
Entropie-Temperatur-Diagramm von Wasserdampf (1 MPa = 10 bar)Im Entropie-Temperatur-Diagramm ist klar zu erkennen, dass beim Übergang von Flüssigkeit zu Dampf die Entropie zunimmt. Dies entspricht der Anschauung, dass die Teilchen einer Flüssigkeit wesentlich geordneter sind als die chaotische Vermengung der Teilchen bei einem Gas. Auf Grund dieses Sachverhaltes wird die Entropie auf der x-Achse aufgetragen. Eine weitere Besonderheit des Diagramms ist seine Eigenschaft, die zur Verdampfung des Wassers notwendige Wärmemenge als Fläche darzustellen. Mit der Beziehung: ΔH = T · ΔS ergibt sich für die Verdampfungsenthalpie eine Rechteckfläche, die zwischen T = 0 K und der jeweiligen Verdampfungsgeraden aufgespannt wird.
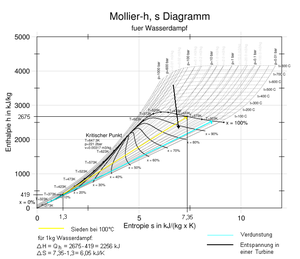
h-s-Diagramm
Bei einem Mollier-Diagramm wird die Entropie des Dampfes auf der x-Achse und die zugehörige Enthalpie auf der y-Achse aufgetragen. Die grundlegenden physikalischen Eigenschaften des Wasserdampfes lassen sich hier nicht so einfach interpretieren, jedoch können die zur Zustandsänderung des Dampfes nötigen Wärmemengen, also beispielsweise die Verdampfungsenthalpie, direkt von der y-Achse abgelesen werden.
Magnus-Formel
Eine Näherungsformel für die Berechnung des Sättigungsdampfdruckes in Abhängigkeit von der Temperatur ist die Magnus-Formel:
mit der Temperatur θ in °C und den Koeffizienten
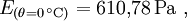
Diese Formel ist sehr genau (< 0,22 %) im Bereich zwischen 0 und 100 °C und immer noch gut (<4,3 %) zwischen -20 und 374 °C (maximaler Fehler bei 290 °C). Sie wird wegen ihres einfachen Aufbaues und wegen ihrer hohen Genauigkeit bei den auf der Erde üblichen Temperaturen der Luft vor allem in der Meteorologie und in der Bauphysik zur Taupunktbestimmung verwendet.
Mit leicht unterschiedlichen Koeffizienten
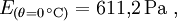
ergeben sich Werte, die auf 0,1 % mit der in DIN 4108 abgedruckten Tabelle für bauphysikalische Berechnungen übereinstimmt.
Die Magnus-Formel wurde von Heinrich Gustav Magnus auf empirischem Weg, das heißt durch Messungen, gefunden und seitdem lediglich durch genauere Werte ergänzt. Eine aus der Thermodynamik abgeleite Gesetzmäßigkeit für Phasendiagramme stellt die Clapeyron-Gleichung bzw. die Clausius-Clapeyron-Gleichung dar. Aufgrund vieler praktischer Probleme in Bezug auf diese eher theoretischen Gleichungen stellt die Magnus-Formel jedoch trotzdem die beste bzw. praktischste Näherung dar. Durch eine Anpassung der Werte auf ein Genauigkeitsoptimum in anderen Temperaturbereichen ließe sich bei Bedarf mit der Magnus-Formel auch bei diesen Temperaturen eine bessere Näherung ermöglichen.
Näherungs-Formel
Eine brauchbare Faustformel für die Berechnung der Sattdampftemperatur aus dem Sattdampfdruck und umgekehrt ist:
![{\theta} = \sqrt[4]{p} \cdot 100](/pictures/dewiki/54/698c6c0bc3f394cafe951183f37db6d2.png) ,
,
wenn man den Druck p in bar(absolut) einsetzt. Die zugehörige Temperatur θ ergibt sich in Grad Celsius; diese Formel ist im Bereich p kr. > p > p = 3bar (200 °C > θ > 100 °C) auf etwa 3% genau.
Beeinflussung des Klimas
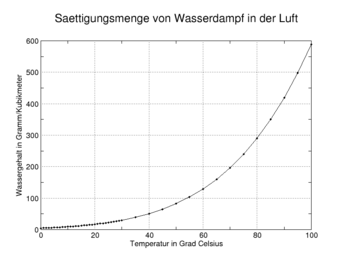
Im terrestrischen Wettergeschehen spielt Wasserdampf eine entscheidende Rolle. Ein Kilogramm Luft kann bei 30 °C und 1 bar Druck etwa 26 Gramm Wasserdampf als Luftfeuchtigkeit aufnehmen. Diese Menge fällt beispielsweise bei 10 °C auf etwa 7,5 g/kg ab. Die überschüssige Menge wird als Niederschlag in Form von Tau, Reif, Raureif, Nebel, Schnee, Hagel oder Regen aus der Luft ausgeschieden. Durch die Bildung von Wolken aufgrund des kondensierenden Wasserdampfs wird eine starke Dämpfung der Sonneneinstrahlung auf die Erde hervorgerufen.
Der in der Erdatmosphäre vorhandene Wasserdampf ist zudem ein bedeutendes Treibhausgas und mit ca. 36-70 % für den natürlichen Treibhauseffekt mit verantwortlich. Dieser für den Strahlungshaushalt der Erde wichtige Effekt hat eine Erhöhung der globalen Durchschnittstemperatur von etwa -18 °C auf ein Niveau von 15 °C zur Folge. Das Leben auf der Erde wird dadurch überhaupt erst möglich. An der globalen Erwärmung ist Wasserdampf verstärkend, aber nicht ursächlich beteiligt, d.h. dass der bloße Ausstoß von Wasserdampf nicht zur Erwärmung der Erde beiträgt, im Gegensatz zur Emission von Gasen wie Kohlenstoffdioxid.
In der Stratosphäre vorhandene Spuren von Wasserdampf gelten andererseits als besonders klimaschädlich. Die Klimaforscher beobachteten in den letzten 40 Jahren einen Zuwachs des Wasserdampfs in der Stratosphäre von 75 % (siehe polare Stratosphärenwolken) und machen diesen für die Erhöhung der mittleren Erdtemperaturen mitverantwortlich. Die Herkunft des Wasserdampfs in diesen Höhen ist noch unklar, man vermutet jedoch einen Zusammenhang mit der in den letzten Jahrzehnten stark gestiegenen Methanproduktion im Rahmen der industriellen Landwirtschaft. Methan wird in diesen großen Höhen zu Kohlendioxid und Wasserdampf oxidiert, womit allerdings nur die Hälfte des Zuwachses zu erklären ist.
Natürliches Vorkommen
Reiner Wasserdampf kommt in der Natur auf der Erde in Vulkanen, Fumarolen und bei Geysiren vor. Hierbei ist er der wichtigste Parameter bei vulkanischen Eruptionen und bestimmt deren Charakter mit. Es ist dabei maßgebend, dass viele Minerale bzw. Gesteine Wasser oder andere flüchtige Stoffe in ihr Kristallgitter einbinden, besonders unter der Wirkung hoher Drücke. Da Magma beim Aufsteigen in der Kruste eine Druckentlastung erfährt, treibt der Wasserdampf zusammen mit anderen Fluiden aus dem Magma aus und bildet Blasen, welche durch den Druck zunächst jedoch nicht frei expandieren. Unterschreitet der Druck einen bestimmten Wert, so verbinden sich diese Fluidblasen jedoch und führen zu einer Art enormen Siedeverzug, werden also explosionsartig frei. Dabei reißen sie auch größere Mengen Magma mit und verursachen die vergleichsweise seltenen explosiven Vulkanausbrüche. Da der Anteil an Fluiden in den Gesteinen bei konvergierenden Plattengrenzen besonders groß ist, zeigt sich bei diesen auch die deutlichste Tendenz für diesen Vulkantyp.
Wasserdampf ist zudem ein wichtiges Hilfsmittel für den menschlichen Wärmehaushalt. Bei hohen Umgebungstemperaturen wird zur Thermoregulation durch Schwitzen die überschüssige Körperwärme (Verdunstungskälte) an die Umgebung abgegeben. Die dabei umgesetzten Wärmemengen sind erheblich, zur Verdunstung eines Gramms Schweiß werden 2,43 kJ Wärme benötigt. Der gesunde Mensch erzeugt bei normalen Umgebungstemperaturen täglich etwa 500 g Wasserdampf durch Schwitzen, hinzu kommt noch einmal die doppelte Menge mit der ausgeatmeten Atemluft. Mit dieser Menge wird die Körpertemperatur auf 37 °C geregelt.
Wasserdampfeintrag
Bei der Verbrennung von Erdölprodukten werden die Kohlenwasserstoffe der Erdölfraktionen im wesentlichen in Kohlenstoffdioxid und Wasserdampf umgesetzt. Im Autoverkehr sind dies Benzin und Diesel, im Luftverkehr Kerosin, in der Hausheizung Heizöl und in der Industrie Schweröle. Der im Abgas enthaltene kondensierende Wasserdampf macht sich beim Flugzeug durch Kondensstreifen am Himmel bemerkbar. Bei der Verbrennung von Erdgas, das mittlerweile zur Heizung von Gebäuden verwendet wird, fällt wegen der vier Wasserstoffatome im Methanmolekül doppelt soviel Wasserdampf wie Kohlenstoffdioxid an. Dies ist der Grund dafür, dass Brennwertgeräte für Erdgas effektiver arbeiten als für Heizöl.
Wasserdampf wird bei vielen großtechnischen Prozessen als Abfallprodukt in die Atmosphäre eingetragen. Als Abwärme wird Wasserdampf auch in der Wasserstoffwirtschaft auftreten.
Wasserdampf in der Klimatechnik
Eine Klimaanlage ist eine Gebäudeausstattung, die einen definierten Wasserdampfgehalt der Luft garantiert. Um Fertigprodukte aus Eisen- und Stahlwerkstoffen vor Korrosion, Lagerbestände wie Bücher vor Verwitterung und Lebensmittel vor Austrocknung zu schützen, werden Lagerhallen klimatisiert. In der Wohnraumklimatisierung trägt der Wasserdampfgehalt in erheblichem Maße zum Wohlbefinden des Menschen bei. Bei der Beurteilung der Raumluft spielt der Begriff der Behaglichkeit eine zentrale Bedeutung; ein Aspekt ist der als angenehm empfundene Zusammenhang zwischen Raumlufttemperatur und relativer Luftfeuchtigkeit. Dieser wird von einer Klimaanlage sichergestellt.
Quantifizierung von Wasserdampf
Da der Wasserdampf bei verschiedensten Gegebenheiten und Prozessen eine große Rolle spielt, wird er mit unterschiedlichsten Messmethoden bzw. -geräten erfasst und in einer Vielzahl von Größen angegeben.
Für meteorologische Zwecke in Bezug auf die feuchte Luft wird oft die relative Luftfeuchte φ verwendet. Diese kann man unter anderem mit einem Haarhygrometer messen. In der Technik wird in der Regel die absolute Feuchte x verwendet. Diese misst man mit einem LiCl-Geber oder Coulometrischem Feuchtesensor, bei welchen (ausgehend von stark hygroskopischem Diphosphorpentoxid) auf den Wasserdampfgehalt der Luft geschlossen wird. Eine weitere Möglichkeit zur Bestimmung des Wasserdampfgehaltes der Luft ist die Messung ihrer Temperatur an je einem trockenen und angefeuchteten Thermometer, wobei die Messstelle des zweiten Thermometers mit einem wassergetränkten Gewebe umwickelt und zur Förderung der Verdunstung mit einem kleinen Lüfter angeblasen wird. Mithilfe der beiden abgelesenen Werte lässt sich aus dem Mollier-h-x-Diagramm sofort die zugehörige Luftfeuchtigkeit ablesen. Das Psychrometer ist das praktische Ergebnis der Weiterentwicklung dieser Messmethode.
In Dampferzeugern dienen neben Thermometer auch Manometer zur einfachen Messung der Dampfparameter.
Wasserdampf in der Geschichte
Die Erscheinung des Wasserdampfes ist den Menschen seit der Nutzbarmachung des Feuers bekannt; er entstand mehr oder weniger unbeabsichtigt beim Kochen oder beim Löschen der Feuerstelle mit Wasser. Erste Überlegungen zur technischen Nutzung von Wasserdampf werden Archimedes zugeschrieben, der eine Dampfkanone konstruierte. Leonardo da Vinci stellte zu diesem Thema erste Berechnungen an, wonach eine 8 kg schwere Kugel aus einer solchen Kanone verschossen etwa 1.250 m weit fliegen würde.
Heron von Alexandria erfand den Heronsball, eine erste Dampfturbine. Seine Erfindung hatte in der Antike keinen praktischen Nutzwert, sie zeigte aber die technischen Möglichkeiten der Nutzung von Wasserdampf auf.
Auf Denis Papin geht die praktische Ausführung des Schnellkochtopfes zurück. Dieser erste Druckbehälter wurde von Anfang an mit einem Sicherheitsventil ausgerüstet, nachdem es mit einem Prototyp bei den ersten Versuchen zu einem Zerknall kam.
Die Erfindung und Nutzung der Dampfmaschine machten es notwendig, das Arbeitsmittel Wasserdampf theoretisch und praktisch zu untersuchen. Zu den Praktikern gehören James Watt und Carl Gustav Patrik de Laval, die durch die Vermarktung ihrer Maschinen zu wohlhabenden Männern wurden. Zu den Theoretikern gehörte dagegen Nicolas Léonard Sadi Carnot, der sich vom Wasserdampf und der Dampfmaschine zu seinen Überlegungen inspirieren ließ. In die Reihe der Forscher, die sich eingehend mit den Eigenschaften von Wasserdampf beschäftigten, gehören auch Rudolf Julius Emanuel Clausius und Ludwig Boltzmann.
Nutzung in der Technik
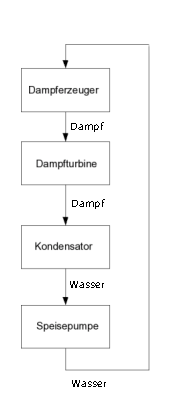 Grundfließbild von Wasser und Dampf in einem Dampfkraftwerk
Grundfließbild von Wasser und Dampf in einem DampfkraftwerkWasserdampf wird in der Technik in Dampfkesseln erzeugt und beispielsweise zu folgenden Zwecken verwendet:
- als Arbeitsmittel in Dampfmaschinen, Dampflokomotiven und Dampfturbinen,
- bei der Förderung von Erdöl und als Hilfsmittel beim Steamcracken für die Herstellung von Benzin,
- als Zwischenprodukt bei der Meerwasserentsalzung,
- als ein Rohstoff für die Herstellung von Wasser- und Generatorgas durch das Steam-Reforming,
- in Dampfheizungen und bei der Siedekühlung als Träger der Wärmeenergie.
- zum Fördern von flüssigem Wasser mit einer Dampfstrahlpumpe,
- bei der Wasserdampfdestillation als Treibmittel,
- Erzeugen eines Vakuums durch Verdrängung der Luft aus einem geschlossenen Druckbehälter mit anschließender Kondensation.
Die derzeit größten Kraftwerk-Dampferzeuger haben eine Leistung von bis zu 3.600 Tonnen Dampf pro Stunde. Derartige Mengen werden beispielsweise mit einem Wasserrohrkessel bereitgestellt.
Beim technischen Einsatz von Wasserdampf ist zu beachten, dass Nassdampf im Unterschied zu den meisten anderen Flüssigkeiten und Gasen nicht gepumpt werden kann. Die beim Verdichten des Dampfes auftretenden Wasserschläge würden die Fördermaschine innerhalb kürzester Zeit zerstören.
Weitere Anwendungen
- zur Bodensterilisation bzw. Bodenhygienisierung durch Dämpfen (Bodendesinfektion) mit Heißdampf
- zur Reinigung mittels Dampfreinigern,
- in der Küche zur schonenden Zubereitung von Lebensmitteln durch Dämpfen,
- in der Mehlerzeugung, vor allem bei Vollkornmehl, zur Stabilisierung des Getreidekeimlings,
- zum Biegen von Holz im Boots- Möbel- und Instrumentenbau,
- zum Erzeugen eines Vakuums in geschlossenen Druckbehältern durch Verdrängung der Luft und anschließende Kondensation,
- zur Sterilisation von medizinischen und mikrobiologischen Instrumenten (sog. autoklavieren),
- im Haushalt zum Bügeln von Wäsche.
In der Medizin und Therapeutik wird Wasserdampf für die Wärmeübertragung und als Träger therapeutischer Stoffe verwendet:
- Inhalation zur Heilung, etwa von Husten, oder zur Linderung von Erkältungen, z. B. mit Inhalatoren oder einer Gesichtssauna,
- im Wellnessbereich in Dampfbädern.
Gefahren durch Wasserdampf
Geringe Mengen Wasserdampf können große Mengen Wärme und damit Energie transportieren. Aus diesem Grund ist das zerstörerische Potenzial von dampfführenden Apparaturen wie Dampferzeuger und Rohrleitungen erheblich. Kesselzerknalle von Dampfkesseln gehörten zu den schwersten Unfällen in der Technikgeschichte, derartige Ereignisse haben in der Vergangenheit mit einem Schlag ganze Industriebetriebe ausgelöscht.
Der mit hoher Temperatur und hohem Druck aus einem defekten Dampfkessel frei austretende Wasserdampf ist unsichtbar, solange er überhitzt ist und kann einen Strahl von erheblicher Länge bilden. Betrachtet man das oben aufgeführte h-s-Diagramm, bedeutet die Freisetzung von Sattdampf zuerst eine adiabate Zustandsänderung, bei der der Druck reduziert wird. Den Ausgangspunkt bildet die Sattdampfkurve rechts vom kritischen Punkt (= Sattdampfzustand im Kessel). Die Druckreduzierung verläuft parallel zur x-Achse (die Enthalpie bleibt gleich). Der austretende Freistrahl vermischt sich mit der Umgebungsluft und kühlt ab. Bei Unterschreitung von 100 °C (= Sattdampftemperatur bei Umgebungsdruck) beginnt der Dampf zu kondensieren und sichtbar zu werden.
Eine Gefahr bei großen Dampfaustritten ist die Bildung von Nebel, der für Flüchtende die Orientierung sehr erschwert. Weiterhin kann ausströmender überhitzter Wasserdampf sogar Brände auslösen.
Hinzu kommt ein Nachverdampfen von flüssigem Wasser durch die in der Umgebung der defekten Stelle eintretende Druckverringerung. Ein großflächiger Kontakt mit diesem Strahl ist wegen der augenblicklich eintretenden Verbrühungen tödlich. In der letzten Zeit sind im Zusammenhang mit Wasserdampf weniger Unfälle geschehen, weil sich der Stand der Technik auf diesem Gebiet permanent zu größeren Sicherheiten hin entwickelt hat.
Aufgrund des großen Volumenunterschiedes zwischen Wasser und Wasserdampf (1:1.700) ist es gefährlich, bestimmte Brände mit Wasser zu löschen. Bei einem Kaminbrand kann das Löschwasser zu einem Zerreißen des Kamins führen und somit die Löschkräfte gefährden und großen Sachschaden anrichten. Auch ein Fettbrand darf nicht mit Wasser gelöscht werden, da dieses unter das brennende Fett sinkt, dort verdampft, sich dabei ausdehnt und brennendes Fett mit hochreißt, es kommt zur Fettexplosion.
Begriffe und Stoffwerte
- Name
- Wasserdampf
- weitere Namen
- Diagramm rechts
- Summenformel
- H2O
- Dichte bei 100 °C und 1,01325 bar
- 0,598 kg/m3
- spez. Wärmekapazität cp
- 2,08 kJ/kgK
- Wärmeleitfähigkeit λ
- 0,0248 W/(m·K)
- Tripelpunkt
- 273,160 K entspricht 0,01 °C
- 0,00612 bar
- kritischer Punkt
- 374,150 °C
- 221,20 bar
Siehe auch
- Kinetische Gastheorie
- Ein leeres TS-Diagramm für Wasser und Wasserdampf
- Ein leeres Mollier-hs-Diagramm für Wasserdampf in hoher Auflösung auf den Wikimedia-Commons
- Taupunktdifferenz
Literatur
- Allgemeine Meteorologie. Nr. 1. Deutscher Wetterdienst Zentralamt, Offenbach 1987. (3.Aufl.) ISBN 3-88148-236-9.
- Meyers großer Rechen Duden. Bibliographisches Institut, Zürich 1969, 1980 (3.Aufl.) ISBN 3-411-00920-9 .
- Dubbel Kapitel D. Springer, Berlin 1990. (17. Aufl.) ISBN 3-540-52381-2.
- Mollier h,s-Diagram for Water and Steam. Springer, Berlin 1998. ISBN 3-540-64375-3.
- Walter Wagner: Wasser und Wasserdampf im Anlagenbau. Kamprath-Reihe. Vogel, Würzburg 2003. ISBN 3-8023-1938-9.
- Properties of Water and Steam in SI-Units. Thermodynamische Eigenschaften von Wasser und Wasserdampf, 0 - 800 °C, 0 - 1000 bar. Springer, Berlin 1981. ISBN 3-540-09601-9, ISBN 0-387-09601-9.
Weblinks
-
- ↑ z.B. Wasserdampftafel)
- Homepage der International Association for the Properties of Water and Steam (engl.)
- Wasserdampftafel für flüssiges Wasser und Sattdampf
- Wasserdampfkalkulation Freeware im MS-Excel, OpenDocument und anderen Formaten
- Internet-Werkzeug zur Bestimmung beliebiger thermodynamischer Zustände von Wasserdampf
- WEBGEO-Modul: Kondensation und Feuchtemaße - WEBGEO - E-Learning-Portal für Geographie und Nachbarwissenschaften
- Programmdownload (Win) "Air Humid Handling" zum Berechnen mithilfe des Mollier h-x-Diagramms
- Klassische Wasserdampftafel als Excel-Tabelle - derzeit kein gültiger Link
Wikimedia Foundation.


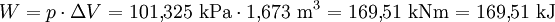
.jpg)
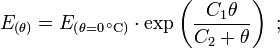
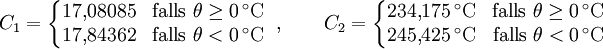

.jpg)