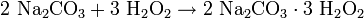- Natriumcarbonatperoxohydrat
-
Strukturformel 
Allgemeines Name Natriumpercarbonat Andere Namen Natriumcarbonatperoxohydrat
Summenformel 2 Na2CO3 · 3 H2O2 CAS-Nummer 15630-89-4 Kurzbeschreibung farb- und geruchloses, brandfördendes Pulver Eigenschaften Molare Masse 314,02 g·mol−1 Aggregatzustand fest
Dichte 2,14 g·cm−3[1]
Schmelzpunkt Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [3] 

Brand-
förderndGesundheits-
schädlich(O) (Xn) R- und S-Sätze R: 8-22-41 S: 3-8-17-26 LD50 1034 mg/kg (oral, Ratte) [2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumpercarbonat (2 Na2CO3 · 3 H2O2) ist eine Anlagerungsverbindung (Addukt) von Wasserstoffperoxid H2O2 an Natriumcarbonat (Soda, Na2CO3).
Inhaltsverzeichnis
Geschichte
Natriumpercarbonat (PCS) ist seit 1899 bekannt. Es konnte sich als Bleichmittel in Waschpulvern gegen das chemisch beständigere Natriumperborat nicht durchsetzen. Nur während des Ersten und Zweiten Weltkriegs, als Bormineralien knapp waren, erfolgte in Deutschland eine nennenswerte Produktion. Nach dem Zweiten Weltkrieg blieb PCS ein Nischenprodukt für Gebissreiniger und Fleckenwasser. Erst Anfang der 1990er wurde durch neue Coating-Verfahren (Beschichtung der PCS-Kristalle) die Lagerfähigkeit erhöht und Natriumpercarbonat ein marktfähiges Bleichmittel. 2004 betrug die Produktionskapazität in den EU-25-Staaten fast 500.000 Tonnen.
Gewinnung und Darstellung
Die Herstellung von Natriumpercarbonat erfolgt industriell nach einem trockenen Spray-Granulationsverfahren oder einem nassen Kristallisations-Verfahren. Beide Verfahren bauen auf einer Anlagerung von Wasserstoffperoxid an Natriumcarbonat auf:
Beim klassischen Nassverfahren wird eine Natriumcarbonatlösung mit Wasserstoffperoxid versetzt und durch Kühlung auskristallisiertes Natriumpercarbonat abzentrifugiert. Anschließend wird in einem Wirbelbetttrockner auf die gewünschte Restfeuchte getrocknet.
Beim trockenen Spray-Granulationsverfahren werden eine Natriumcarbonat- und eine Wasserstoffperoxid-Lösung gemeinsam auf ein von Warmluft durchströmtes Wirbelbett aus kleinen Natriumpercarbonat-Impfkristallen gesprüht und zum Auskristallisieren gebracht. Entstehende Feuchtigkeit wird mit der Luft ausgetragen.
Beide Verfahren können kontinuierlich betrieben werden. Nicht umgesetzte Rohstoffe werden in den Reaktionsraum zurückgeführt. Typische Verunreinigungen von technischem Natriumpercarbonat sind Natriumcarbonat (< 15 %), Natriumsulfat (< 10 %) und Natriumchlorid (< 5 %).[1]
Eigenschaften
Natriumpercarbonat bildet farblose Kristalle, die sich gut in Wasser lösen, die Lösung reagiert stark alkalisch. Der Feststoff ist reizend und ätzend. Unter Wärmeeinwirkung wird ab 50 °C das Wasserstoffperoxid wieder abgespalten, das weiter zu Wasser und aktivem Sauerstoff zerfällt. Mit zunehmender Temperatur steigert sich die Reaktionsgeschwindigkeit.
Verwendung
Natriumpercarbonat als Bleichmittel und Oxidationsmittel ist ökologisch unbedenklicher als das früher vielfach verwendete Natriumperborat, da es kein Bor enthält. Im Gegensatz zu Natriumperborat ist Natriumpercarbonat für Pflanzen ungiftig. Natriumpercarbonat ist Bestandteil vieler Wasch- und Maschinengeschirrspülmittel. Es setzt beim Reinigungsvorgang über 60 °C Sauerstoff frei, der bleichbare Flecken (unter anderem von Tee, Rotwein, Gras oder Obst) beseitigt. Die Farbstoffe werden oxidiert und dadurch farblos, teilweise werden fleckenbildende Substanzen sogar in wasserlösliche überführt und mit der Waschlauge entfernt.
Natriumpercarbonat ist neben verschiedenen Tensiden und Enzymen der Hauptwirkstoff der meisten "Oxi-Reiniger".
Quellen
- ↑ a b Inchem: SIDS Initial Assessment Report
- ↑ a b Hansagroup: Sicherheitsdatenblatt
- ↑ a b Eintrag zu Dinatriumcarbonat, Verbindung mit Hydrogenperoxid (2:3) in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12. Februar 2008 (JavaScript erforderlich)
Wikimedia Foundation.