- Nickeldihydroxid
-
Kristallstruktur 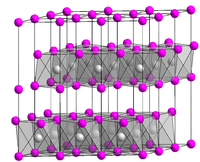
__ Ni2+ __ OH- Allgemeines Name Nickel(II)-hydroxid Andere Namen Nickeldihydroxid
Verhältnisformel Ni(OH)2 CAS-Nummer 12054-48-7 Kurzbeschreibung apfelgrünes Pulver[1] Eigenschaften Molare Masse 92,71 g/mol Aggregatzustand fest
Dichte 4,15 g/cm3[1]
Schmelzpunkt 285 °C [1](Zersetzung zu Nickel(II)-oxid)
Löslichkeit Praktisch unlöslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-61-20/22-38-42/43-48/23-68-50/53 S: 53-45-60-61 LD50 1515 mg/kg (oral, Ratte)[3]
WGK 3 (stark wassergefährdend)[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nickel(II)-hydroxid ist eine chemische Verbindung des Metalls Nickel, die zur Gruppe der Hydroxide gehört.
Inhaltsverzeichnis
Vorkommen
Natürlich kommt Nickel(II)-hydroxid in Form des sehr seltenen Minerals Theophrastit vor.[4]
Gewinnung und Darstellung
Nickel(II)-hydroxid entsteht beim Nachweis von Nickel-Ionen aus Nickelsalzlösungen mit Natronlauge als Ausfällung mit deutlicher Grünfärbung:
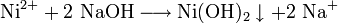
- Nickel(II)-Ionen aus Nickelsalzlösungen (wie z.B. in Wasser aufgelöstes Nickel(II)-chlorid) reagieren mit Natronlauge zu grünem, wasserunlöslichem Nickel(II)-hydroxid und Natrium-Ionen.
Bei Überschuss von Ammoniak löst sich das Nickel(II)-hydroxid unter Blaufärbung als Hexammin-Komplex wieder auf:
![\mathrm{Ni(OH)_2 + 6 \ NH_3 \longrightarrow [Ni(NH_3)_6]^{2+} + 2 \ OH^-}](/pictures/dewiki/53/54dc8ca496968f049242173634d22230.png)
- Nickel(II)-Ionen reagieren bei Überschuss von Ammoniak zu blauen, wasserlöslichen Hexaaminnickel(II)-Ionen und Hydroxid-Ionen.
Chemische Eigenschaften
Durch Zugabe von starken Oxidationsmitteln wie Chlor oder Brom, jedoch nicht mit Wasserstoffperoxid, geht Nickel(II)-hydroxid in das schwarze Nickel(IV)-oxid über:
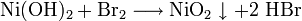
- Grünes Nickel(II)-hydroxid reagiert mit Brom zu schwarzem, wasserunlöslichem Nickel(IV)-oxid und Bromwasserstoff.
Verwendung
Nickel(II)-hydroxid wird zum Galvanisieren, als Hauptbestandteil für Platten alkalischer Akkumulatoren (siehe Nickel-Eisen-Akku, Nickel-Cadmium-Akkumulator, Nickel-Wasserstoff-Akkumulator und Nickel-Metallhydrid-Akkumulator) und zum Herstellen von Nickelkatalysatoren verwendet[5].
Sicherheitshinweise
Wie viele Nickelverbindungen wird Nickel(II)-hydroxid als krebserzeugend (Kategorie 3) eingestuft[6]. Zusätzlich wirkt Nickel(II)-hydroxid sensibilisierend.
Quellen
- ↑ a b c d Eintrag zu CAS-Nr. 12054-48-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 16.8.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 12054-48-7 im European chemical Substances Information System ESIS
- ↑ MSDS bei Fisher Scientific
- ↑ Mineralienatlas.de: Theophrastit
- ↑ Schweizerische Eidgenossenschaft: Erzeugnisse der chemischen Industrie oder verwandter Industrien
- ↑ FH Nürnberg: MAK-Liste
Wikimedia Foundation.
