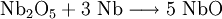- Nioboxid-Struktur
-
Strukturformel 
Allgemeines Name Niob(II)-oxid Andere Namen Niobmonoxid
Summenformel NbO CAS-Nummer 12034-57-0 Kurzbeschreibung graues Pulver Eigenschaften Molare Masse 108,9 g/mol Aggregatzustand fest
Dichte 7,3 g/cm3[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Niob(II)-oxid ist eine chemische Verbindung von Niob und Sauerstoff. Der graue Feststoff ist neben Niob(V)-oxid und Niob(IV)-oxid eines von mehreren stabilen Oxiden des Niobs. Im Gegensatz zu den anderen Nioboxiden ist die Verbindung elektrisch leitend (etwa 106 S/cm[2]) und wird als Anodenmaterial in Niob-Elektrolytkondensatoren verwendet.
Inhaltsverzeichnis
Gewinnung und Darstellung
Niob(II)-oxid lässt sich durch Reaktion von Nioboxiden mit elementarem Niob bei hohen Temperaturen herstellen. Das genaue Verhältnis der Edukte hängt vom verwendeten Oxid ab.[3]
Eigenschaften
Niob(II)-oxid besitzt eine ungewöhnliche Kristallstruktur. Diese lässt sich als eine von der Natriumchloridstruktur ableitbare geordnete Defektstruktur beschreiben. Sechs Niobatome bilden dabei eine oktaedrischen Cluster, bei dem das sonst in der Natriumchloridstruktur vorhandene zentrale Anion fehlt. Gleichzeitig fehlen an den Ecken der Elementarzelle die Niobatome.[2]
Innerhalb des Metallclusters liegen Niob-Niob-Bindungen mit einer Bindungslänge von 298 pm vor. Diese sind in ihrer Länge denen des elementaren Niobs sehr ähnlich (Nb-Nb: 285 pm) und bedingen die metallischen Eigenschaften des Niob(II)-oxids.[2]
Verwendung
Niob(II)-oxid wird als Anodenmaterial in Niob-Elektrolytkondensatoren verwendet. Diese spielen wie die entsprechenden Tantal-Kondensatoren eine wichtige Rolle in der Mikroelektronik, beispielsweise in Laptops. Im Vergleich zu Tantalkondensatoren sind sie billiger, können aber nicht so hohe Spannungen aushalten.[4] Ein weiterer Vorteil von Niob(II)-oxid ist die höhere Temperaturstabilität im Vergleich zu Tantal.[3]
Quellen
- ↑ a b Sicherheitsdatenblatt (alfa-aesar)
- ↑ a b c Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, S. 1265–66, ISBN 3-527-26169-9.
- ↑ a b Charles A. Motchenbacher et.al.: Production of high-purity niobium monoxide and capacitor production therefrom, United States Patent 7157073, 2007.
- ↑ Ch. Schnitter: The taming of niobium. In: Bayer research, Bayer AG, 2004.
Wikimedia Foundation.