- Aspro
-
Strukturformel 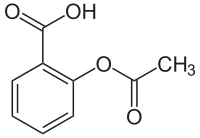
Allgemeines Freiname Acetylsalicylsäure Andere Namen Summenformel C9H8O4 CAS-Nummer 50-78-2 PubChem 2244 ATC-Code DrugBank APRD00264 Arzneistoffangaben Wirkstoffklasse Wirkmechanismus irreversibler Cyclooxygenasen-Inhibitor
Fertigpräparate - Aspirin® (Weltweit)
- Aspirin®Cardio (CH)
- Alcacyl® (CH)
- Acesal® (D)
- Alka-Seltzer® (D)
- ASS (diverse Hersteller) (D)
- Godamed® (D)
- HerzASS-ratiopharm® (D)
- Miniasal® (D)
- Togal® ASS 400 mg (D)
Verschreibungspflichtig: Teilweise Eigenschaften Molare Masse 180,16 g·mol−1 Dichte Schmelzpunkt 135,0 °C [1]
Siedepunkt 140,0 °C (Zersetzung) [1]
pKs-Wert 3,49 [1]
Löslichkeit wenig löslich in Wasser (4,6 g·l−1 bei 25 °C) [2]
Sicherheitshinweise Gefahrstoffkennzeichnung [1]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 22 S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 WGK 1 – schwach wassergefährdend [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Acetylsalicylsäure, kurz ASS, ist ein weit verbreiteter schmerzstillender und blutgerinnungs- und entzündungshemmender sowie fiebersenkender Wirkstoff. Namensgebend für den Wirkstoff waren die Weidengewächse (lateinisch Salicaceae), aus denen erstmals diese Substanz gewonnen werden konnte. ASS wurde insbesondere unter dem Markennamen Aspirin® bekannt.
Inhaltsverzeichnis
Geschichte
Schon im antiken Griechenland wurde der Saft der Weidenrinde gegen Fieber und Schmerzen aller Art eingesetzt. Hippokrates von Kos, Dioscurides und auch der römische Gelehrte Plinius der Ältere sahen die Weidenrinde als Arznei an.[4] Durch Kochen von Weidenbaumrinden haben Germanen und Kelten Extrakte gewonnen und zu Heilzwecken verwendet, die der synthetischen Acetylsalicylsäure verwandte Substanzen enthielten. 1763 meldete der in Oxford lebende Geistliche Edward Stone der Royal Society in London, dass diese aus der Überlieferung bekannte Erkenntnis korrekt sei.[4] 1828 gelang es Johann Andreas Buchner, das Salicin (den Vorläufer von ASS) aus eben jenen Weidenrindenextrakten (Weide, Salix sp.) zu isolieren. 1853 synthetisierte Charles Frédéric Gerhardt erstmals unreine Acetylsalicylsäure.[4] Seit 1874 wurde Salicylsäure durch Friedrich von Heyden großtechnisch in seiner Salicylsäurefabrik Dr. F. v. Heyden in Radebeul hergestellt und als Medikament eingesetzt, jedoch schränkten der bittere Geschmack und Nebenwirkungen wie Magenbeschwerden die Einsatzmöglichkeiten ein. Bibergeil (auch Castoreum), ein Drüsensekret der Analdrüse des Bibers, enthält ebenfalls den Inhaltsstoff der Weidenbaumrinde, Salicylsäure. Es wurde bis ins 19. Jahrhundert gegen Krämpfe, hysterische Anfälle, Nervosität u.v.m eingesetzt. Schon in der gräco-romanischen Antike wurde die Substanz gegen Epilepsie eingesetzt.
1897 wurde die Acetylsalicylsäure erstmals in reiner Form hergestellt. Sowohl Felix Hoffmann als auch Arthur Eichengrün werden als Erfinder diskutiert.[5] Da letzterer Jude war, wurde seine wissenschaftliche Arbeit zur Zeit des Nationalsozialismus zunehmend behindert und seine Leistungen geschmälert. Sicher ist, dass Eichengrün nach der Zulassung von Aspirin zum Leiter der pharmazeutischen Abteilung bei der Bayer AG befördert und Hoffmann Leiter der Marketing-Abteilung wurde. Bayer vermarktete jedoch vorerst das elf Tage später von Hoffmann entwickelte, als Heroin bekannt gewordene Diacetylmorphin (DAM) stärker, da man nach Versuchen an Menschen davon ausging, dass Aspirin zu viele Nebenwirkungen habe.
1949 veröffentlichte Arthur Eichengrün eine Arbeit, in der er schrieb, er habe die Entwicklung von Aspirin sowie einiger benötigter Hilfsstoffe geplant und koordiniert. Schon zuvor aus dem KZ – fast ein halbes Jahrhundert nach der Erfindung von Aspirin – schrieb Eichengrün der I.G. Farben (Bayer), als er sich, wie er selber sagte, seinem Tode nahe sah, dass Hoffmann an Aspirin nur in der Weise beteiligt war, dass er die Anordnungen Eichengrüns befolgte, ohne überhaupt zu wissen, was er im Auftrage Eichengrüns tat. Während des Nationalsozialismus wurde er weiterhin als Beteiligter oder gar Erfinder verleugnet, wie dies bei allen jüdischen Errungenschaften üblich war und öffentlich die Erfindung des Aspirins vor allem Hoffmann zugesprochen. Eichengrün hat dies selbst, nach seiner Entlassung, in einer noch aus Zeiten des Nationalsozialismus stammenden Ausstellung - über deren Pforte „Juden ist der Zutritt verboten“ prangte – auf einer Tafel zum Thema Aspirin gelesen. Auf ihr wurden Hoffmann und eine andere, mit der Entwicklung Aspirins nicht in Verbindung stehende Person als Erfinder genannt, ohne jegliche Erwähnung Eichengrüns. In vielen geschichtlichen Abhandlungen bzw. Lexika zu dem Thema wird aufgrund dieser Vorgänge während des Nationalsozialismus und der damit entsprechend beeinflussten Geschichtsbücher vornehmlich Felix Hoffmann als Erfinder oder wahrscheinlicher Erfinder genannt und die Erklärung Eichengrüns in seiner 1949 veröffentlichen Arbeit oftmals lediglich als Behauptung betitelt.
Das Produkt wurde 1897 Aspirin genannt. Der Name Aspirin leitet sich vom Echten Mädesüß, auch Spire genannt (veraltet: Spiraea ulmaria L. heute: Filipendula ulmaria (L.) Maxim.), einem salicylathaltigen Rosengewächs, ab: 'A' (für die Acetylgruppe), -'spirin' (für den Inhaltsstoff der Spire). Aspirin® – der Markenname wurde am 6. März 1899 in die Warenzeichenrolle des Kaiserlichen Patentamtes aufgenommen – wurde 1899 zum Patent angemeldet.
Nach dem Ersten Weltkrieg wurde Bayer im Rahmen des Versailler Vertrags gezwungen, das Patent und die Rechte an der Marke Aspirin® für das Gebiet der Siegermächte USA, Frankreich und Großbritannien aufzugeben. In den USA kaufte 1918 Sterling Drug die Markenrechte von der amerikanischen Verwaltung für feindlichen Besitz. In den fünfziger Jahren des 20. Jahrhunderts verlor Sterling Drug kraft Gerichtsbeschluss die Exklusivrechte am Namen. Der Name Aspirin wurde so in den USA gemeinfrei. Im Jahre 1994 kaufte Bayer Sterling Drug vom vorübergehenden Eigentümer Kodak für 1 Milliarde Dollar. Seitdem verkauft Bayer in den USA wieder „Bayer-Aspirin“. Es ist weltweit das meistgekaufte ASS-Präparat.
Die Funktionsweise der Acetylsalicylsäure, nämlich die Hemmung der Prostaglandinproduktion, wurde 1971 von John Robert Vane aufgeklärt,[6] wofür er 1982 zusammen mit Sune Bergström und Bengt Samuelsson den Nobelpreis für Medizin erhielt.[7]
Chemische und physikalische Eigenschaften
Acetylsalicylsäure ist der Trivialname für 2-Acetoxybenzoesäure, wie sie nach den IUPAC-Regularien heißt. Die phenolische Hydroxylgruppe in ortho-Stellung zur Carbonsäuregruppe der o-Hydroxybenzoesäure ist mit Essigsäure verestert. Dadurch hat das Gesamtmolekül einen hydrophilen und einen lipophilen Anteil.
Acetylsalicylsäure liegt als weißes Pulver vor oder bildet flache bis nadelförmige Kristalle mit schwachem Geruch nach Essigsäure. Der pKs-Wert beträgt 3,5. Sie schmilzt bei einer Temperatur von 135 °C, ihr Zersetzungspunkt liegt bei ca. 140 °C. Acetylsalicylsäure ist gut löslich in Ethanol, Alkalilauge, aber schlecht löslich in Benzol oder kaltem Wasser (3,3 g·l−1 bei 20 °C). Die Wasserlöslichkeit steigt erheblich beim Erwärmen. Die Dichte von Acetylsalicylsäure beträgt 1,35 g·cm−3, der Dampfdruck ist gering.
Pharmakologie
Wirkungen
Acetylsalicylsäure wirkt durch Hemmung der Cyclooxygenase COX-1 schon in kleinen Dosen (30–50 mg) gerinnungshemmend, mit steigender Dosis (0,5–2 g) durch Hemmung der Cyclooxygenase COX-1 und COX-2 und der daraus folgenden, sinkenden Bildung von Prostaglandinen auch dezentral schmerzstillend, antirheumatisch sowie fiebersenkend und schließlich (2–5 g) entzündungshemmend. Prostaglandine sind unter anderem auch an der Regelung der Magensäuresekretion und der Magenschleimhautdurchblutung beteiligt, so dass durch die Hemmung der Prostaglandinsynthese bei höheren Dosierungen und längerfristiger ASS-Einnahme, beispielsweise im Rahmen der Behandlung von rheumatischen Beschwerden, Magenbeschwerden und Magenblutungen auftreten können. Die Magenunverträglichkeit beruht zu einem wesentlichen Teil auf der (gewünschten) systemischen Hemmung der Prostaglandinsynthese und lässt sich durch andere Darreichungsformen (magensaftresistente Tablette, Zäpfchen oder intravenöse Gabe) allenfalls abmildern. Eine Arzneiform, die auf der Magenschleimhaut aufliegend den Wirkstoff abgibt, beeinträchtigt das Gewebe des Magens kurzzeitig jedoch noch zusätzlich. Über die Hemmung der Prostaglandinsynthese kann die Acetylsalicylsäure auch die Entartung von gutartigen Darmgeschwülsten zu Krebs behindern. Bei der kurzzeitigen Anwendung in Dosierungen von 500–1000 mg bei akuten Schmerzen ist Acetylsalicylsäure in seiner Verträglichkeit in etwa mit den anderen apothekenpflichtigen Schmerzmitteln vergleichbar.
Wirkmechanismus
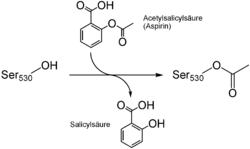
Die Wirkung der Acetylsalicylsäure beruht auf einer irreversiblen Hemmung der Prostaglandin-H2-Synthase, genauer der Cyclooxygenasen COX-1 und COX-2. Diese Enzyme katalysieren die Bildung von entzündungsverstärkenden Prostaglandinen und Thromboxan A2, das u. a. thrombozytenaktivierend wirkt. Die Acetylsalicylsäure überträgt bei der Hemmung einen Acetylrest auf einen Aminosäurerest (Serin 530) kurz vor dem katalytischen Zentrum. Dadurch kann die Arachidonsäure als Substrat des Enzyms das aktive Zentrum nicht mehr erreichen und das Enzym wird dauerhaft inaktiviert. Die COX-1 wird durch Acetylsalicylsäure etwa 10–100 mal stärker gehemmt als die COX-2. Da Thrombozyten aufgrund des fehlenden Zellkerns keine Enzyme nachbilden können, ist die gerinnungshemmende Wirkung auf sie irreversibel - die Wirkungsdauer deckt sich daher mit der Überlebenszeit der Thrombozyten (8–11 Tage).
Ein weiterer indirekter Wirkmechanismus scheint die indirekte Hemmung der Cyclooxygenase zu sein: Aspirin verstärkt effektiv die Aktivität der Cytochrom P450-Isoformen CYP2E1 und CYP4A1 welche Arachidonsäure zu Epoxyeicosatriensäuren abbauen. Einige dieser Epoxyeicosatriensäuren gehören zu den endogenen Antipyretika, also Stoffen des Körpers, die die Fieberreaktion begrenzen; sie hemmen die Cyclooxygenase-2 effektiver als das Aspirin an sich.[8]
Pharmakokinetik
Acetylsalicylsäure unterliegt einem ausgeprägten First-pass-Metabolismus (z.T. schon in der Magen- und Darmwand durch spezielle Esterasen) und hat eine orale Bioverfügbarkeit von etwa 70 %. Im Körper wird sie schnell zu dem Hauptmetaboliten Salicylsäure umgewandelt. Im Blut geht sie zu 50 bis 70 % eine Bindung an Albumin ein.
Substitution
Bei rheumatischen Erkrankungen werden anstatt Acetylsalicylsäure in Deutschland häufig andere NSAID (nicht steroidale antientzündliche Pharmaka: Diclofenac, Naproxen, Ibuprofen), oder die noch auf dem Markt befindlichen, so genannten COX-2-Hemmer eingesetzt.
Nebenwirkungen und Gegenanzeigen
Die bei analgetischer Dosierung auftretenden Nebenwirkungen sind meist leichterer Art: Übelkeit, Sodbrennen und Erbrechen werden relativ häufig beobachtet. Bei Asthmatikern kann Acetylsalicylsäure Ursache von Anfällen sein, die sich dadurch erklären, dass durch Hemmung der Cyclooxigenasen ein Überangebot an Arachidonsäure vorliegt, die dann die Bildung von bronchokonstriktorischen (die Bronchien verengenden) Leukotrienen begünstigt. Eine Kreuzreaktion zu anderen Schmerzmitteln wie beispielsweise Ibuprofen, Diclofenac oder Naproxen ist häufig.
Die Arzneimittelkommission der deutschen Ärzteschaft weist darauf hin, dass Acetylsalicylsäure aufgrund ihrer Reizwirkung bei regelmäßiger Einnahme Schleimhautreizungen, Blutungen im Magen-Darm-Trakt und Magengeschwüre verursachen kann. Bei chronisch entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcerosa) ist Vorsicht geboten, da Acetylsalicylsäure schubauslösend wirken kann.
Bei Kindern und Jugendlichen mit fieberhaften Erkrankungen sollte Acetylsalicylsäure nicht eingesetzt werden, da es (möglicherweise nach einer überstandenen Viruserkrankung) das mitunter tödliche Reye-Syndrom auslösen könnte; es sollte auf alternative Substanzen – wie Paracetamol oder Ibuprofen – ausgewichen werden. In Großbritannien ist die rezeptfreie Abgabe von Acetylsalicylsäure an Kinder und Jugendliche unter 16 Jahren aus diesem Grund verboten. Diskutiert wird auch eine suppressive Wirkung auf das unspezifische Immunsystem, da der Immunmodulator Desoxycholsäure (Literatur) erst nach Abklingen der Wirkungen der Acetylsalicylsäure aktiv werden kann. Dennoch gibt es auch im Kindesalter Krankheitsbilder, bei denen die Behandlung mit Acetylsalicylsäure durchaus angezeigt ist. Dazu gehören das rheumatische Fieber oder das Kawasaki-Syndrom.
In der Schwangerschaft darf Acetylsalicylsäure nur in kleinen Mengen verabreicht werden, da ASS insbesondere im dritten Trimenon zu einem vorzeitigen Verschluss des Ductus arteriosus botalli des ungeborenen Kindes führen kann. Außerdem besteht durch die gehemmte Blutgerinnung eine erhöhte Blutungsneigung der Mutter bei der Geburt.
Laut einer Untersuchung der Boston University School of Medicine sterben jährlich 16.500 Amerikaner an Magenblutungen, die durch Aspirin und ähnliche Schmerzmittel verursacht werden; in 170.000 Fällen kommt es zu schwerwiegenden Magenschäden. Gleichzeitig kann eine häufige Einnahme zu Magengeschwüren oder Bauchspeicheldrüsenkarzinomen führen.
Bei Asthmatikern beträgt der Anteil der Patienten mit ASS-Intoleranz etwa 8 bis 20% und bei Patienten mit Nasenpolypen etwa 6 bis 15%. Diese Allergie wird als Samter-Trias bezeichnet. Es wird eine genetische (erbliche) Prädisposition vermutet.[9]
Im Tierversuch ergaben sich laut Roter Liste Hinweise auf eine mögliche teratogene Wirkung bei chronischer Einnahme von ASS während der Schwangerschaft.
Toxizität
Hohe Dosen, beispielsweise 10 g ASS beim Erwachsenen, können bereits zu einer lebensgefährlichen metabolischen Azidose (Übersäuerung) mit Atemlähmung und Bewusstlosigkeit führen. Außerdem kann das Innenohr geschädigt werden, was sich in einem Hörverlust oder Tinnitus äußert. Auch Nierenschädigungen sind beschrieben worden (Analgetikanephropathie).
Nebenwirkungen der Schmerzmittelgruppe um ASS, der Nichtopioid-Analgetika (also zusammen mit Paracetamol, Ibuprofen u. a.) gehören zu den 16 häufigsten Todesursachen in den USA. Da aber die Zahl der Opfer frei verkäuflicher Schmerzmittel in Statistiken nicht einzeln aufgeführt wird, nimmt die Öffentlichkeit die Gefahren v. a. einer gewohnheitsmäßigen oder dauernden Einnahme kaum wahr.
Die Gefahrstoffkennzeichnung mit dem Gefahrensymbol und dem R-Satz gesundheitsschädlich beim Verschlucken beziehen sich auf größere Mengen des Wirkstoffes, wie sie bei dessen Produktion gehandhabt werden, selbstverständlich jedoch nicht auf die Mengen in fertigen Tabletten bei deren Einnahme gemäß Beipackzettel.
Die mittlere letale Dosis (LD50) bei oraler Aufnahme liegt bei Ratten bei 200 mg/kg Körpergewicht.[2]
Fehlindikationen
Als Schmerzmittel zur Unterdrückung von Wundschmerz wie z.B. nach chirurgischen Eingriffen oder Verletzungen ist Acetylsalicylsäure ungeeignet, da die gerinnungshemmende Wirkung bis etwa 7 Tage nach der letzten Einnahme anhält und damit Blutungen begünstigt. Wegen der irreversiblen Hemmung der Cyclooxygenase in den Thrombozyten ist auch eine Gabe eines Gegenmittels zur sofortigen Aufhebung der Gerinnungshemmung nicht möglich. Es muss vielmehr abgewartet werden, bis neue, funktionsfähige Thrombozyten vom Körper gebildet werden. Auf diese Weise kann eingenommene Acetylsalicylsäure eine dringende medizinische Operation (oder ihren Termin) vereiteln, denn mangelnde Gerinnung führt zu Komplikationen wie zu großem Blutverlust. Auf jeden Fall müssen die behandelnden Ärzte über die Acetylsalicylsäure-Einnahme informiert werden.
Einsatzgebiete
Acetylsalicylsäure wird nicht nur als Schmerzmittel, zur Fiebersenkung und als Antirheumatikum eingesetzt, sondern vor allem auch niedrigdosiert zur Hemmung der Thrombozytenaggregation und damit zur Vorbeugung von erneuten Herzinfarkten und Schlaganfällen (Sekundär/Tertiärprophylaxe) bei bekannten arteriosklerotischen Gefäßveränderungen verwendet. Ebenfalls kommt es als Thrombozytenaggregationshemmer zum Einsatz, wenn beispielsweise bei Vorhofflimmern aus individuellen Gründen keine Antikoagulation mit Phenprocoumon in Frage kommt.
Aufgrund seiner positiven Wirkungen bei Polycythaemia vera wurde Aspirin® von der Europäischen Kommission der Status einer orphan drug erteilt. Somit hat die Bayer HealthCare AG die alleinigen Vermarktungsrechte für ein ASS-Präparat zur Behandlung dieser Krankheit. [10]
Resistenzdiskussion
Eine Acetylsalicylsäure-Resistenz unterschiedlicher Ausprägung wurde in einer kleinen Studie festgestellt, wobei wohl auch die Darreichungsform Einfluss nimmt.[11] Aus diesem Grund gibt es eine Kontroverse über die Einführung von Geräten, um Patienten, die einen Gerinnungshemmer benötigen, auf Acetylsalicylsäure-Resistenz testen zu lassen. Schlussfolgerung wäre bei einem positiven Test, einen anderen Gerinnungshemmer (z. B. zur Vorsorge gegen erneute Infarkte) zu verschreiben. Clopidogrel ist dafür ein Kandidat, jedoch ist dieser etwa 100-mal so teuer wie Acetylsalicylsäure. Aus diesem Grund hat die Pharmaindustrie eine starke Motivation, für die Einführung von Acetylsalicylsäure-Resistenz-Tests zu werben, während Krankenversicherungen und teilweise Ärzte diesbezüglich eher zurückhaltend sind.[12]
Handelsnamen und Darreichungsformen
Acetylsalicylsäure wird als Monopräparat weltweit in über 500 Fertigarzneimitteln in der Darreichungsform von Tabletten, Sublingualtabletten, Filmtabletten, Schmelztabletten, Trinktabletten, Pulver, Kautabletten, Kaudragées, Brausetabletten, Retardtabletten, Kapseln, Retardkapseln, Injektionslösungen, Suppositorien und Dragées vermarktet.[13] Nachfolgend einige Beispiele von Handelsnamen: D: Acesal®, Alka-Seltzer®, Aspirin®, Delgesic®, Godamed®; CH: Alcacyl®, Asa-Tabs®, Aspégic®, Aspirin®, Aspro®, Togal®; A: Acekapton®, Aspirin®, Aspro Classic®, Salimont®, Togal Mono®
Herstellung
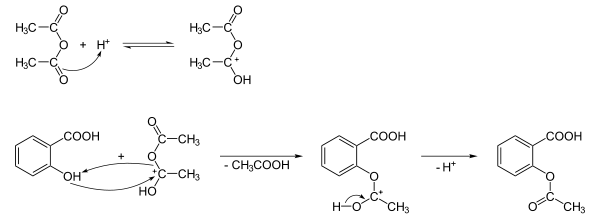
Phenol wird mit Kohlenstoffdioxid durch eine Kolbe-Schmitt-Synthese in ortho-Stellung carboxyliert. Das notwendige Kohlenstoffdioxid wird dabei in situ aus Natriumhydrogencarbonat erzeugt. Die entstandene Salicylsäure wird anschließend mit Essigsäureanhydrid an der phenolischen Hydroxylgruppe zu Acetylsalicylsäure verestert (acetyliert).
Nachweis
Nach Hydrolyse in NaOH kann der Nachweis der freigesetzten Salicylsäure mit FeCl3 (blauer Chelatkomplex)[14] oder Hydroxamsäurereaktion[15] stattfinden. Der Nachweis von Essigsäure oder Acetat erfolgt durch Geruchsprüfung, Veresterung mit Chlorethan (Entstehung von charakteristisch riechendem Ethylacetat[16]) oder Versetzen mit Lanthan(III)-Nitrat (La(NO3)3) und Iod (blaue Färbung).[17]
Quellen
- ↑ a b c d e f Eintrag zu Acetylsalicylsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 19.11.2007 (JavaScript erforderlich)
- ↑ a b c Acetylsalicylsäure bei ChemIDplus
- ↑ Bekemeier, H. (1955): Salicylamid- und Salicylsäure-Vergiftung bei der Katze im Vergleich mit anderen Tieren. I. In: Arzneimittelforschung. Bd. 5, S. 572–575. PMID 13276287
- ↑ a b c Lafont O.: „From the willow to aspirin“. Rev Hist Pharm (Paris). 2007 Jul;55(354):209-16. PMID 18175528
- ↑ Zum Vortrag von Dr. Walter Sneader über die Entwicklung der Acetylsalicylsäure (Presseerklärung Bayer AG, 1999) September 1999.
- ↑ Vane, J. R. (1971): Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. In: Nat. New Biol. Bd. 231, S. 232–235. PMID 5284360
- ↑ Nobelpreis für Medizin oder Physiologie 1982: „Für ihre bahnbrechenden Arbeiten über Prostaglandine und nahe verwandter biologisch aktiver Substanzen.“ Informationen der Nobelstiftung zur Preisverleihung.
- ↑ Kozak, W. et al. (2000): Molecular mechanisms of fever and endogenous antipyresis., Ann N Y Acad Sci. 2000;917:121-134; PMID 11268336.
- ↑ A. May u. a.: Familienuntersuchung bei Patienten mit ASS-Intoleranz und Rhinosinusitis. In: HNO, 48/2000, S. 650–4.
- ↑ Entscheidung der EU-Kommission vom 29.07.2004 über die Ausweisung des Arzneimittels "Acetylsalicylsäure" als Arzneimittel für seltene Leiden gemäß Verordnung (EG) Nr. 141/2000 des Europäischen Parlaments und des RatesPDF
- ↑ Studie zur ASS-Resistenz auf neurologyreviews.com
- ↑ K. Schrör & H.-Ch. Diener: Sekundärprävention bei TIA und Schlaganfall - Clopidogrel oder ASS? In: CARDIOVASC. 2/2001, S. 8.
- ↑ Pharmavista - Datenbank Internationale Fertigarzneimittel
- ↑ K. Hohmann : Organisches Grundpraktikum. Versuch: Nachweis von Salicylsäure, Philipps-Universität Marburg, Script Wintersemester 2007/2008
- ↑ Nachweis von Carbonsäuren, Estern und Ethern (pdf), Script der Universität des Saarlandes, Wintersemester 2004
- ↑ H. Kallbacher: Chemisches Praktikum für Mediziner: Synthese eines Arzneimittels Acetylsalicylsäure (ASS, Aspirin®), Kurstag 8, Praktikumsscript der Eberhard-Karls-Universität Tübingen
- ↑ F. v. Bruchhausen, H. Hager: Hagers Handbuch Der Pharmazeutischen Praxis. Band 2 Methoden., S. 124, Springer-Verlag, 1994, ISBN 978-3-540-52688-9
Literatur
- Nicolai Kuhnert (1999): Hundert Jahre Aspirin. In: Chemie in unserer Zeit. Bd. 33, Nr. 4, S. 213–220. doi:10.1002/ciuz.19990330406
- Kay Brune & Tobias Egger (2002): Die Entwicklung der antipyretischen Analgetika. In: Pharmazie in unserer Zeit. Bd. 31, Nr. 2, S. 133–139. DOI
- Andrew T. Chan et al. (2007): Long-term Aspirin Use and Mortality in Women. In: Arch. Intern. Med. Bd. 167, S. 562–572. PMID 17389287
Weblinks
- Synthese von Acetylsalicylsäure (PH Heidelberg)
- Darstellung von Acetylsalicylsäure (Chemieversuche.com)
- biochemische Grundlagen der Aspirin-Wirkung (FIZ Chemie Berlin)
- Aspirin (englisch)
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.