- Ouabain
-
Strukturformel 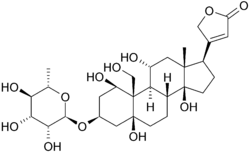
Allgemeines Freiname g-Strophanthin Andere Namen - Ouabain
- Ouabagenin-L-rhamnosid
- (1β,3β,5β,11α)- 3-(6-Desoxy-α-L-mannopyranosyloxy)- 1,5,11,14,19-pentahydroxycard- 20(22)-enolid
- 3β-(α-L-Rhamnopyranosyloxy)- 1β,5,11α,14,19-pentahydroxy- 5β,14β-card-20(22)-enolid
Summenformel C29H44O12 CAS-Nummer 630-60-4 PubChem 439501 ATC-Code C01AC01
DrugBank DB01092 Kurzbeschreibung farblose, glänzende Kristalle mit bitterem Geschmack [1] Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Hemmung bzw. Aktivierung der Na+/K+-ATPase
Fertigpräparate Strodival®
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 584,65 g·mol-1 Schmelzpunkt Löslichkeit 10 g·l-1 in Wasser bei 20 °C [2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3]
T
GiftigR- und S-Sätze R: 23/25-33 S: (1/2)-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Strophanthin (von griech. στροφή, „Strophe“, hier im Sinne von „Wendung, Schlängelung“ bezogen auf die Strophanthin enthaltenden Schlinggewächse, und ἄνϑος, „Blüte“) – auch in verbreiteter Falschschreibung ohne das zweite th als Strophantin – auch engl. Ouabain, ist ein Cardenolid-Glycosid, das als Herzglycosid zur Behandlung von Herzkrankheiten eingesetzt wird. Das Aglykon ist g-Strophanthidin (Ouabagenin). Der Rezeptor für Strophanthin ist die Na+/K+-ATPase.
Intravenös zugeführtes Strophanthin wurde bis 1992 bei akuter Herzinsuffizienz als das am schnellsten wirksame Glycosid empfohlen. Heute plädieren auch hinsichtlich der Behandlung der chronischen Herzinsuffizienz die internationalen Leitlinien generell erst an zweiter Stelle für Glykoside, dabei jedoch meist für die Anwendung von Digoxin[4].
Inhaltsverzeichnis
Vorkommen und Nomenklatur
Strophanthin kommt im Samen von verschiedenen afrikanischen Pflanzen der Gattung Strophanthus aus der Familie der Hundsgiftgewächse vor.
Die Namen bekannter Strophanthine sind von verschiedenen Strophanthus-Arten abgeleitet:
- e-Strophanthin aus Strophanthus eminii
- g-Strophanthin aus S. gratus und Acokanthera oblongifolia.
- h-Strophanthin aus S. hispidus
- k-Strophanthin aus S. kombé
Auch in der Pflanze Acokanthera (Acokanthera oblongifolia, A. ouabaio und A. schimperi), die auch bisweilen bei uns als Topfpflanze zu finden ist, ist das Strophanthin zu finden. Ouabain, die angelsächsische Bezeichnung für g-Strophanthin, hat seinen Namen vom afrikanischen Ouabaio-Baum (Acokanthera ouabaio), dessen Samen das g-Strophanthin enthält. Ouabaio ist die englische Schreibung des ostafrikanischen Wortes Wabayo.
Die jeweilige Substanz aus Strophanthus kombe und S. gratus gehört zu den herzwirksamen Digitaloiden (vgl. Herzglykoside) und ist von den eigentlichen – aus dem Fingerhut (Digitalis) stammenden – Digitalisglykosiden zu unterscheiden.
Die auch bei uns heimische Sommer-Adonisröschen (Adonis aestivalis) enthält Strophanthidin, das Aglycon des k-Strophanthins, welches ebenfalls sehr giftig ist.
Geschichte
Die Eingeborenen Afrikas verwendeten die Samen der Strophanthus-Arten als Pfeilgift.
1859 wurde die Herzwirkung des Strophanthus-Samens entdeckt, als während der Livingstone-Expedition in Afrika die Zahnbürste des Biologen Kirk von diesem unbemerkt in Kontakt mit dem Strophanthus-Pfeilgift kam und unmittelbar darauf dessen Herzbeschwerden verschwanden. 1862 gelang es dem schottischen Pharmakologen und Kliniker Thomas Fraser, aus dem Samen des Strophanthus kombé k-Strophanthin zu isolieren. 1885 wurde der Gesamtextrakt von S. kombé als Tinctura strophanthia in die Herztherapie eingeführt und 1893 ins deutsche Arzneibuch aufgenommen. 1888 isolierte der französische Chemiker Arnaud das g-Strophanthin aus Strophanthus gratus und Acokanthera ouabaio, welches ab 1904 als Reinsubstanz zur oralen Einnahme zur Verfügung stand.
Die therapeutische Weiterentwicklung und der Nachweis der schnellen und starken Wirkung bei intravenös verabreichtem k-Strophanthin geht auf den deutschen Arzt Albert Fraenkel zurück, der es ab 1905 bei Herzinsuffizienz anwandte. In Zusammenarbeit mit ihm entwickelte das damalige Pharmaunternehmen Boehringer Mannheim die erste intravenöse Darreichungsform Kombetin®, die bis zum Ende des 20. Jahrhunderts im Handel war. Ab 1906 war der Einsatz intravenös applizierten Strophanthins allgemein anerkannt. Ernst Edens (1876 - 1944) setzte intravenöses Strophanthin ab 1928 auch bei Angina Pectoris und Herzinfarkt erfolgreich ein, einer damals noch seltenen Erkrankung. Nach 1950 wurde intravenöses Strophanthin in der Therapie der chronischen Herzinsuffizienz aufgrund des Aufkommen der oral verfügbaren Digitalis-Präparate immer weniger verwendet.
Der Stuttgarter Internist Berthold Kern führte 1947 oral verabreichtes g-Strophanthin zur Vorbeugung und Behandlung der Angina Pectoris und des zunehmend aufkommenden Myokardinfarktes ein.
Hamlyn et al. isolierten erstmals 1991 auch aus menschlichem Blutplasma vermutlich ein Stereoisomer des g-Strophanthins (Ouabain), das ihrer Ansicht nach eine Rolle als blutdrucksteuerndes Hormon spielt und aus der Nebenniere stammt: Endogenes Ouabain. Die Bildung im Gehirn (Hypothalamus) wird mittlerweile ebenfalls als gesichert angesehen. Der Gießener Biochemiker Wilhelm Schoner (emeritiert) konnte nachweisen, dass g-Strophanthin ein körpereigenes (endogenes) Kreislaufhormon ist, das bei körperlicher Belastung bereitgestellt wird. D'Urso et al. berichten 2004, dass das Herz der Ratte während einer experimentellen Minderdurchblutung (durch koronare Einschnürung) g-Strophanthin produziert.
Wirkprinzip und Anwendung
Herzinsuffizienz
In höheren Konzentrationen, die klinisch nur durch hohe Dosierungen intravenös verabreichten Strophanthins zu erreichen sind, hemmt der Wirkstoff die in der Zellmembran lokalisierte Natrium-Kalium-Pumpe, den Rezeptor für Herzglycoside. Diese Natrium-Kalium-Pumpe (Natrium-Kalium-ATPase), die besonders zahlreich (millionenfach) in Nerven- und Herzmuskelzellen vorkommt, pumpt Natriumionen aus der Zelle hinaus und Kaliumionen hinein, was für viele fundamentale Zellfunktionen wichtig ist. Diese Hemmung der Natrium-Kalium-Pumpe wird als die klassische Wirkung der Herzglycoside angesehen, die über den erhöhten zellulären Gehalt an Natrium und somit auch Calcium (via Natrium-Calcium-Austauscher) zu einer Steigerung der Kontraktionskraft der Herzmuskelzelle führt (sog. positiv inotroper Effekt), ein wichtiges Wirkprinzip bei Herzinsuffizienz, der klassischen Indikation für Herzglycoside.
Koronare Herzkrankheit
In geringen, physiologischen Konzentrationen, wie sie als Hormon, nach oraler Gabe sowie auch nach langsamer intravenöser Injektion in niedriger Dosierung gemessen werden, wirkt Strophanthin hingegen stimulierend auf die Natrium-Kalium-Pumpe, was zur Senkung des zellulären Natrium- und Calciumgehalts führt [5]. Die Natrium-Kalium-Pumpe reguliert u. a. den intrazellulären pH-Wert. Auch Digoxin und weitere herzwirksame Steroide aus der Nebenniere wurden mittlerweile im menschlichen Blut gefunden. Sie scheinen eine Rolle bei der Kontrolle der Elektrolytkonzentrationen zu spielen und die Natrium-Kalium-Pumpe der Zellmembran zu spielen. Sowohl bei essentieller Hypertonie als auch bei dilatatativer Kardiomyopathie fand man erhöhte Serumspiegel. Ob sich die Substanzen zur Therapie des hohen Blutdrucks eignen, ist noch unklar [6].
Nach Herstellerangabe verbessert die Substanz ähnlich wie Nitroglycerin die Sauerstoffmangeltoleranz und die sogenannte Vorlast des Herzens bei Patienten mit Koronarinsuffizienz. Oral eingenommenes Strophantin hat eine mäßig positiv inotrope (kraftsteigernde) Wirkung bei gleichzeitigen antianginösen Effekten [7]. Einige Ärzte setzen Strophantin auch zur Vorbeugung von Herzinfarkten ein.
Toxikologie
Zur Frage, ob die Giftpfeile der Eingeborenen auch bei Elefanten und Nashörnern wirken konnten, gibt es kontroverse Informationen. Noch heute wird die Wirkung des Giftes bei Mordanschlägen in Ostafrika benutzt.
Der therapeutische Einsatz anderer Herzglycoside, insbesondere der Digitalis-Glycoside (Digoxin, Digitoxin), bei denen sich der therapeutische und der toxische Bereich mitunter sogar überschneiden können, sollte möglichst unter Kontrolle der Blutspiegel erfolgen. Orales Strophanthin ist wahrscheinlich aufgrund des zellulären Wirkmechanismus (Stimulation der Na-K-ATPase durch physiologische Konzentrationen), der demjenigen von Digitalis entgegengesetzt ist (Hemmung der Na-K-ATPase, s. o.), unproblematischer zu handhaben; ernste Nebenwirkungen von oralem Strophanthin sind de facto nicht bekannt, obschon solche in der Roten Liste aufgrund der Einordnung als Herzglycosid aufgeführt sind (es handelt sich hier um die bei Digitalis beobachteten Nebenwirkungen). Selbstmordversuche mit sogar 900 mg g-Strophanthin (entsprechend 150 beziehungsweise 300 Kapseln) scheiterten. Bei intravenösem Strophanthin ist wiederum Vorsicht angeraten (üblicher therapeutischer Bereich bis 0,25 mg).
Resorption
Die pharmakologischen Lehrbücher (auch internationale Standardwerke) geben niedrige und schwankende Resorptionswerte (unter 10 %) für oral gegebenes g-Strophanthin an. Eine Reihe von Studien am Tier mit radioaktiver Markierung des g-Strophanthin-Moleküls nennt jedoch wesentlich höhere Resorptionswerte.
Erhältliche Darreichungen
- Strodival®, 3 mg pro Zerbeißkapsel, rezeptpflichtig
- Strodival mr®, 3 mg pro magensaftresistente Kapsel, rezeptpflichtig
- Oleum Strophanthi forte®, anthroposophisches Präparat, Weichkapseln, rezeptpflichtig
- strophactiv, homöopathisches g-Strophanthin (D4), frei erhältlich
Quellen
- ↑ a b Hermann Ammon (Hrsg.): Hunnius pharmazeutisches Wörterbuch. 8. Auflage, de Gruyter, Berlin 2004. ISBN 3-11-015792-6
- ↑ a b Strophanthin bei ChemIDplus
- ↑ Eintrag zu CAS-Nr. 630-60-4 im European chemical Substances Information System ESIS
- ↑ Leitlinien zur Therapie der chronischen Herzinsuffizienz der Deutschen Gesellschaft für Kardiologie (PDF, 391 kB)
- ↑ z. B. Gao et al. 2002, Saunders & Scheiner-Bobis 2004
- ↑ Schoner W, Scheiner-Bobis G: Endogenous and exogenous cardiac glycosides and their mechanisms of action. Am J Cardiovasc Drugs. 2007 (7):173-89. PMID: 17610345
- ↑ Fachinformation der Meda GmbH zu Strodival, Stand 2001
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
