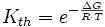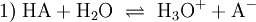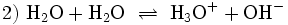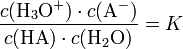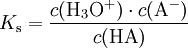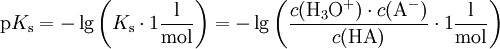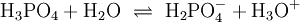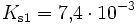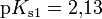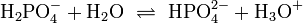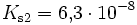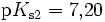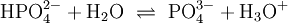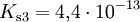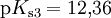- PK-Wert
-
Die Säurekonstante Ks ist eine Stoffkonstante und gibt Aufschluss darüber, in welchem Maße ein Stoff in einer Gleichgewichtsreaktion mit Wasser unter Protolyse reagiert:
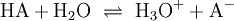 .
.
Dabei steht HA für eine Brønsted-Säure (nach Brønsted), die ein Proton H+ an ein Lösungsmittel wie Wasser abgeben kann, wobei ein Anion A- zurückbleibt.[1] Allgemeiner gilt die Brønsted'sche Definition auch für nichtwässrige Systeme, hier gilt für ein beliebiges, protonierbares Lösungsmittel Y:
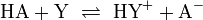 .
.
Ks ist die Gleichgewichtskonstante dieser Reaktion und damit ein Maß für die Stärke einer Säure. Je stärker die Säure, desto mehr ist die Reaktion auf die rechte Seite verschoben. Die Gleichgewichtskonstante wird meist als ihr negativer dekadischer Logarithmus, dem pKs-Wert angegeben (auch pKa, vom engl. acid = Säure). Hierbei bedeutet: je kleiner der pKs-Wert, desto stärker ist die Säure.
Inhaltsverzeichnis
Herleitung der Säurekonstanten
Die Säurekonstante leitet sich als Gleichgewichtskonstante einer chemischen Reaktion aus der Gibbs-Energie G (auch Freie Enthalpie) her. Ist diese bekannt, so gilt für die Gleichgewichtskonstante Kth einer beliebigen chemischen Reaktion:
wobei R die Universelle Gaskonstante, T die Temperatur und e die eulersche Zahl ist. Die Formel beschreibt so auch die beobachtbare Temperaturabhängigkeit der Säurekonstanten.
Kth ist dabei als Produkt der Aktivitäten definiert und ist eine dimensionslose Größe. Werden Mischungseffekte vernachlässigt, gilt ai = ci / ci,ref. Dies ist in Lösungen bis 1 mmol/l ohne größere Fehler möglich. Konstanten können daher mit den Aktivitäten wie auch mit den Konzentrationen aufgestellt werden. Sie besitzen jedoch einen anderen Zahlenwert. Bedingt durch die historische Entwicklung der Chemie aus einer praktischen Wissenschaft, werden meist die konzentrationsbezogenen Konstanten angegeben, da diese experimentell vor der thermodynamischen Begründung gefunden wurden.
Säurestärke
Die Eigenschaft eines bestimmten Stoffes, als Säure zu reagieren, ist untrennbar verknüpft mit seiner potentiellen Fähigkeit, ein Proton (H+) an einen Reaktionspartner zu übertragen. Man nennt eine solche Reaktion Protolyse. Die Stärke einer Säure beschreibt das Ausmaß dieser Fähigkeit. Diese ist jedoch abhängig von der Fähigkeit eines Reaktionspartners, das Proton aufzunehmen. Soll die Säurenstärke verschiedener Säuren verglichen werden, ist es sinnvoll, die Wechselwirkung mit einem Standardreaktionspartner zu betrachten. Dieser ist in der Regel das Wasser, das auch in vielen Vorgängen in der Natur die bedeutsamste Verbindung und Lösemittel ist. Die Reaktionsgleichung einer Säure HA in und mit Wasser kann so dargestellt werden:
In dieser Reaktion stellt sich schnell ein Gleichgewicht ein. Hier verfügt neben HA auch H3O+ über die Fähigkeit, ein Proton an einen Reaktionspartner zu übertragen: Sie sind beide Säuren. H2O und auch A− haben hingegen die Fähigkeit ein Proton aufzunehmen, weswegen man sie beide als Basen bezeichnet. Trennt man gedanklich die Standardreaktionspartner Wasser und H3O+ ab, bleiben HA und A− übrig. Da die Konzentrationen dieser Komponenten an ein Gleichgewicht gebunden sind, ist das Ausmaß der Fähigkeit von HA, eine Säure zu sein, gekoppelt an das Ausmaß der Fähigkeit von A−, eine Base zu sein. Hat beispielsweise HA ein großes Potenzial, ein Proton abzugeben und A− ein kleines Potenzial, ein Proton anzunehmen, nennt man HA eine starke Säure. Das Gleichgewicht (1) würde auf der rechten Seite stehen. Hätten beide Partner ein hohes oder beide Partner ein niedriges Potenzial, wäre HA eine schwache Säure. Das Gleichgewicht (1) würde in beiden Fällen auf der linken Seite stehen.
Die Säurekonstante (bzw. der pKs-Wert) als dimensionslose Zahl (ohne Maßeinheit) ist ein Maß für die Stärke einer Säure. Die Acidität ist umso größer, je geringer ihr pKs-Wert ist. Der pKs-Wert ist numerisch gleich dem pH-Wert einer Lösung, wenn HA und A− nach Gleichgewicht (1) in gleicher Konzentration vorliegen.
In wässrigen Lösungen dissoziieren sehr starke Säuren und sehr starke Basen vollständig zu H3O+- bzw. OH−-Ionen. So lassen sich die unterschiedlichen Säurestärken von Chlorwasserstoff und Perchlorsäure in Wasser nicht mehr anhand des pH-Wertes unterscheiden. Hier spricht man vom nivellierenden Effekt (v. frz.: niveler = gleichmachen) des Wassers. Um auch sehr starke Säuren bezüglich der Säurestärke unterscheiden zu können, bestimmt man Gleichgewichtskonstanten in nichtwässrigen Lösungen und überträgt diese annäherungsweise auf das Lösungsmittel Wasser.
Der Standardreaktionspartner Wasser hat eine besondere Eigenschaft, als Säure und Base reagieren zu können:
Diese sogenannte Autoprotolyse erlaubt die Bestimmung das Ausmaß der Fähigkeit einer Base, ein Proton vom Wasser zu übernehmen, und wird unter Basenkonstante näher erläutert.
Säure-Base-Reaktion
Zwischen einer Säure HA und seiner Base A− liegt in wässriger Lösung folgende Gleichgewichtsreaktion vor:
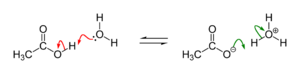 Beispiel: Säure-Base-Reaktion von Essigsäure und Wasser
Beispiel: Säure-Base-Reaktion von Essigsäure und WasserNach dem Massenwirkungsgesetz wird die Lage des Gleichgewichtes durch die Gleichgewichtskonstante K beschrieben:
Da die Konzentration von Wasser (c(H2O)) bei der Reaktion praktisch konstant bleibt, lässt sich c(H2O) in die Konstante K einbeziehen. Damit ergibt sich schließlich die Säurekonstante Ks:
Häufig wird der negative dekadische Logarithmus von Ks, der so genannte pKs-Wert angegeben.
Je kleiner der pKs-Wert, desto stärker ist die Säure. So hat zum Beispiel Salpetersäure (HNO3, Dissoziationsgrad von 96 % bei einer Konzentration von 1 mol/L) den pKs-Wert −1,32, Essigsäure (Dissoziationsgrad von 0,4 % bei einer Konzentration von 1mol/L) einen pKs von 4,75. Bei Wasser, in dem ja nur noch eines von rund 107 Molekülen dissoziiert, beträgt der pKs-Wert 15,74.
Entsprechend gibt es eine Basenkonstante (pKb-Wert). Je kleiner der pKb-Wert, desto stärker das Bestreben der Base, Protonen aufzunehmen. Über den pKs-Wert kommt man durch Umrechnung auf die Basekonstante der korrespondierenden Base:
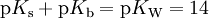 bzw.
bzw.
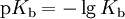 .
.
(bei Standardbedingungen)
Mehrprotonige Säuren
Bei einer mehrprotonigen Säure besteht eine schrittweise Protolyse. Für jede Dissoziationsstufe liegt eine eigene Säurekonstante bzw. pKs-Wert vor. Für die einzelnen Protolyseschritte gilt im Allgemeinen: Ks1 > Ks2 > Ks3 (bzw. pKs1 < pKs2 < pKs3), da aus der steigenden Ionenladung des entstehenden Säurerestanions die weiterführende Protolyse weniger energetisch begünstigt ist. Als Beispiel gilt für die Phosphorsäure:
Der Ksgesamt setzt sich multiplikativ aus den Ks-Werten der einzelnen Protolysestufen zusammen.
Bestimmung von pKs-Werten
Die Bestimmung des pKs-Wertes erfolgt über pH-Messung in einer Halbtitration. Liegen die (schwache) Säure und die dazugehörige (korrespondierende) Base in gleicher Konzentration vor, so folgt hier aus Ks entsprechend dem MWG: pH = pKs (am Halbäquivalenzpunkt).
Der pKs-Wert einer starken Säure entspricht oft dem pH-Wert einer einmolaren Lösung, denn der Wert c(HA) unter dem Bruchstrich nimmt den Wert 1 an (1 mol/L) und der pKs-Wert ist der negative dekadische Logarithmus der Säurekonstanten Ks.
Acidität organischer Säuren
Bei Organischen Säuren entscheiden vor allem drei Struktureigenschaften über die Säurestärke:
- Stabilisierung des entstehenden Anions durch Mesomerie: So sind z. B. Carbonsäuren saurer als Alkohole. Mesomere Effekte spielen hierbei eine entscheidende Rolle: Ein −M-Effekt (etwa einer Nitrogruppe -NO2) erhöht die Säurestärke, ein +M-Effekt verringert sie.[2]
- Hybridisierung des Kohlenstoffatoms: Mit steigendem s-Gehalt nimmt die Stärke zu. So hat Ethin (sp-Hybridorbital) einen niedrigeren pKs-Wert als Ethen (sp2-Hybridorbital) und dieses einen niedrigeren als Ethan (sp3-Hybridorbital), es gilt also für den pKs-Wert: sp < sp2 < sp3
- Induktive Effekte: Die Säurestärke steigt, wenn elektronenziehende Gruppen vorhanden sind, z. B. Halogene wie Fluor und Chlor oder Sauerstoff. Trichloressigsäure ist beispielsweise stärker als Essigsäure.
Einige Substituenten besitzen sowohl mesomere, als auch induktive Effekte, etwa die Halogene oder Nitrogruppen. Halogene weisen einen starken -I-, aber einen schwachen +M-Effekt auf; die Nitrogruppe wirkt sowohl elektronenanziehend (-I-Effekt), als auch über einen -M-Effekt, d. h. beide Effekte wirken in dieselbe Richtung.[2]
pKs- und pKb-Werte einiger Verbindungen
Säurestärke pKs Säure + H2O 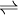 H3O+ + Base
H3O+ + BasepKb Basenstärke sehr stark −10 HClO4 ClO4− 24 sehr schwach −10 HI I− 24 −6 HCl Cl− 20 −3 H2SO4 HSO4− 17 stark −1,74 H3O+ H2O 15,74 schwach −1,32 HNO3 NO3− 15,32 1,92 HSO4− SO42− 12,08 2,13 H3PO4 H2PO4− 11,87 2,22 [Fe(H2O)6]3+ [Fe(OH)(H2O)5]2+ 11,78 3,14 HF F− 10,86 3,75 HCOOH HCOO− 10,25 mittelstark 4,75 CH3COOH CH3COO− 9,25 mittelstark 4,85 [Al(H2O)6]3+ [Al(OH)(H2O)5]2+ 9,15 6,52 H2CO3 HCO3− 7,48 6,92 H2S HS− 7,08 7,20 H2PO4− HPO42− 6,80 schwach 9,25 NH4+ NH3 4,75 stark 9,40 HCN CN− 4,60 10,40 HCO3− CO32− 3,60 12,36 HPO42− PO43− 1,64 13,00 HS− S2− 1,00 15,74 H2O OH− −1,74 sehr schwach 15,90 CH3CH2-OH CH3-CH2-O− −1,90 sehr stark 23 NH3 NH2− −9 34 CH4 CH3− −20 Weblinks
- Bordwell pKs Tabelle in DMSO
- Harvard University: Evans Group pKs Tabelle
- "Acidity constant" definition (from the IUPAC "Gold Book")
- pKs Tabelle CCI ETH
- pKs Tabelle mit sehr vielen Substanzen
Siehe auch
Einzelnachweise
Wikimedia Foundation.