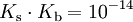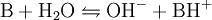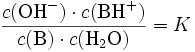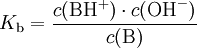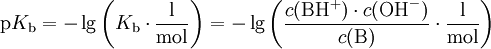- PKb
-
Die Basenkonstante (Kb) ist eine Größe, welche angibt, in welchem Maße eine Base in einem Lösungsmittel alkalisch reagiert. Sie wird eher selten verwendet, da sie sich direkt aus der → Säurekonstante Ks berechnen lässt. Es gilt dabei, dass je kleiner der pKb-Wert, desto stärker das Bestreben der Base, Protonen aufzunehmen. Für in Wasser gelöste Säuren und Basen gilt mit dem Dissoziationsgleichgewicht des Wassers bei 25°C unter Vernachlässigung der Fugazitäten näherungsweise folgende Beziehung:
Säure-Base-Reaktion
Zwischen einer Base B und ihrer Säure BH + liegt in wässriger Lösung folgende Gleichgewichtsreaktion vor:
Nach dem Massenwirkungsgesetz wird die Lage des Gleichgewichtes durch die Gleichgewichtskonstante K beschrieben:
Da die Konzentration von Wasser c(H2O) bei der Reaktion praktisch konstant bleibt, lässt sich c(H2O) in die Konstante K einbeziehen. Damit ergibt sich schließlich die Basenkonstante Kb:
Häufig wird der negative dekadische Logarithmus von Kb, der sogenannte pKb-Wert, angegeben:
Für den pKb-Wert und den analog definierten pKs-Wert gilt bei Zimmertemperatur:
- pKb + pKs = 14
Wikimedia Foundation.