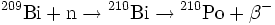- Polonium-210
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Polonium, Po, 84 Serie Metalle Gruppe, Periode, Block 16, 6, p Aussehen silbrig CAS-Nummer 7440-08-6 (209Po) Massenanteil an der Erdhülle 2 · 10-14 % Atomar Atommasse 209,98 u Atomradius (berechnet) 190 (135) pm Elektronenkonfiguration [Xe] 4f145d106s26p4 Elektronen pro Energieniveau 2, 8, 18, 32, 18, 6 1. Ionisierungsenergie 812,1 kJ/mol Physikalisch Aggregatzustand fest Modifikationen α-Po, β-Po Kristallstruktur kubisch-primitiv (α-Po)
rhomboedrisch (β-Po)Dichte 9,196 g/cm3 Schmelzpunkt 527 K (254 °C) Siedepunkt 1235 K (962 °C) Molares Volumen 22,97 · 10-6 m3/mol Verdampfungswärme 102 kJ/mol Schmelzwärme 60,1 kJ/mol Dampfdruck 0,0176 Pa bei 527 K Elektrische Leitfähigkeit 2,19 · 106 A/(V · m) Wärmeleitfähigkeit 20 W/(m · K) Chemisch Oxidationszustände (-2) 2, 4, 6 Oxide (Basizität) PoO2 (amphoter) Normalpotential 0,9 V (Po2+ + 2e- ? Po) Elektronegativität 2,0 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 208Po 2,898 a α 5,215 204Pb ε 1,401 208Bi 209Po 103 a α 4,979 205Pb ε 1,893 209Bi 210Po 99,998 %
138,376 d α 5,407 206Pb 211Po 6 · 10-12 %
0,516 s α 7,595 207Pb 211mPo 25 s α 9,057 207Pb IT 1,462 211Po 212Po 2·10-14 %
304 ns α 8,78 208Pb 212mPo 45,1 s α 11,8 208Pb IT 2,922 212Po 213Po 4 µs α 8,5 209Pb 214Po 1 · 10-11 %
164 µs α 7,69 210Pb 215Po 7 · 10-12 %
1,781 ms α 7,526 211Pb β 0,721 215At 216Po 1 · 10-8 %
0,15 s α 6,78 212Pb 217Po 2s α 6,7 213Pb 218Po 1,6 · 10-5 %
3,05 min α 6,00 214Pb β 0,265 218At NMR-Eigenschaften unbekannt Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben weitere Sicherheitshinweise Radioaktivität
Radioaktives ElementSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Polonium ist ein radioaktives chemisches Element mit der Ordnungszahl 84 und dem Elementsymbol Po. Es wird der Elementgruppe der Chalkogene zugeordnet.
Inhaltsverzeichnis
Geschichte
Polonium wurde 1898 vom Ehepaar Pierre und Marie Curie entdeckt. Zu Ehren von Marie Curies Heimat Polen nannten sie es Polonium (vom lateinischen Wort „Polonia“). Marie Curie verzichtete auf die Patentierung des Gewinnungsverfahrens, damit die Erforschung dieses Elements ungehindert weitergehen konnte. Für die Entdeckung und Beschreibung von Polonium (zusammen mit Radium) erhielt Marie Curie 1911 den Nobelpreis für Chemie.
Gewinnung und Herstellung
Poloniumisotope sind Zwischenprodukte der Thorium-Reihe und der Uran-Radium-Reihe, wobei letztere das häufigste Isotop 210Po produziert. Polonium kann daher bei der Aufarbeitung von Pechblende gewonnen werden (1000 Tonnen Uranpechblende enthalten etwa 0,03 Gramm Polonium [2]). Dabei reichert es sich zusammen mit Bismut an. Von diesem Element kann man es anschließend mittels fraktionierter Fällung der Sulfide (Poloniumsulfid ist schwerer löslich als Bismutsulfid) trennen.
Heutzutage erfolgt die Herstellung von Polonium jedoch im Kernreaktor durch Neutronenbeschuss von Bismut:
Die Halbwertszeit t1/2 für den Betazerfall von 210Bi liegt bei 5,01 Tagen. Durch Destillation werden die beiden Elemente anschließend getrennt (Siedepunkt von Polonium: 962 °C; Siedepunkt von Bismut: 1564 °C). Die Weltjahresproduktion beträgt ca. 100 g [3].
Eigenschaften
Polonium ist ein silberweiß glänzendes Metall. Als einziges Metall weist die α-Modifikation eine kubisch-primitive Kristallstruktur auf. Dabei sind nur die Ecken eines Würfels mit Polonium-Atomen besetzt. Diese Kristallstruktur findet man sonst nur noch bei den Hochdruckmodifikationen von Phosphor und Antimon.
Die chemischen Eigenschaften sind vergleichbar mit denen seines linken Perioden-Nachbarn Bismut. Es ist metallisch leitend und edler als Silber.
Polonium löst sich in Säuren wie Salzsäure, Schwefelsäure oder Salpetersäure.
Isotope
Bekannt sind die Polonium-Isotope 190Po bis 218Po[4], welche ausnahmslos radioaktiv sind. Die Halbwertszeiten sind recht unterschiedlich und reichen von etwa 3·10-7 Sekunden für 212Po bis zu 103 Jahren für 209Po.
Das wichtigste, natürlich vorkommende Isotop 210Po hat eine Halbwertszeit von 138 Tagen und zerfällt unter Aussendung von Alpha-Strahlung in das Blei-Isotop 206Pb. Wegen dieser geringen Halbwertszeit erfolgt aber die Gewinnung des industriell genutzten 210Po überwiegend in Kernkraftwerken.
Radiotoxikologische Bedeutung
Die größte Gefährdung stellt Polonium als Zerfallsprodukt des radioaktiven Edelgases Radon dar. Radon in der Atemluft erhöht das Risiko, an Lungenkrebs zu erkranken. Die eigentliche Ursache ist nicht das Radongas, sondern die Inhalation der kurzlebigen Radonzerfallsprodukte, die sich im Gegensatz zum gasförmigen Radon im Atemtrakt anreichern. Die unter den Zerfallsprodukten befindlichen Poloniumisotope 210Po, 212Po, 214Po, 216Po und 218Po haben die größte radiologische Wirkung, weil sie Alphateilchen aussenden.
Während Alpha-Strahlung etwa bei äußerer Einwirkung bereits von der obersten Hautschicht aus abgestorbenen Zellen abgeschirmt wird, wirkt sie auf den Menschen stark schädigend, wenn Alpha-Strahler in den Körper gelangen. Über den Blutstrom verteilt sich das Polonium im Körpergewebe. Die zerstörerische Wirkung macht sich als Strahlenkrankheit zunächst an Zellen bemerkbar, die sich häufig teilen (z. B. Darmepithelien, Knochenmark). Zu den typischen Symptomen gehören neben Alopezie und allgemeiner Schwäche auch Diarrhö, Anämie sowie Blutungen aus Nase, Mund, Zahnfleisch und Rektum.
Polonium wird vom menschlichen Körper mit einer biologischen Halbwertszeit von ca. 50 Tagen ausgeschieden [5], so dass alle wichtigen Isotope vollständig oder zu einem signifikanten Anteil im menschlichen Körper zerfallen. Darüber hinaus sind Inkorporationen von außen nur schwer zu entdecken und eine Diagnose schwierig, da kaum Gammastrahlung emittiert wird. Reste und Zerfallsprodukte finden sich größtenteils im Kot sowie zu rund 10 % im Urin.
Einer speziellen Polonium-Exposition sind Raucher ausgesetzt. Als mögliche Quellen kommen sowohl die im Tabakanbau eingesetzten Phosphatdüngemittel als auch eine Adsorption atmosphärischer Einträge durch die Tabakpflanzen in Frage. Die Anteile der Teer-Kanzerogene und der radioaktiven Exposition am Prozess der Krebsentstehung werden kontrovers diskutiert.[6][7]
Der Autor Michael Karpin führt den Tod des Physikprofessors Dror Sadeh und mehreren seiner Mitarbeiter am Weizmann-Institut in Israel zwischen 1957 und 1969 auf ein Entweichen von radioaktivem Polonium zurück[8].
Im November 2006 kam das Isotop 210Po dadurch in die internationalen Schlagzeilen, dass der ehemalige russische Geheimdienstagent Alexander Walterowitsch Litwinenko durch diese Substanz starb.
Verwendung
Polonium wird in Verbindung mit Beryllium in transportablen Neutronenquellen benutzt. Dabei wird die Kernreaktion 9Be(α, n)12C zur Erzeugung freier Neutronen genutzt.
In manchen industriellen Ionisatoren wird 210Po eingesetzt, z. B. in Anlagen, in denen Papier, Textil oder synthetische Materialien gerollt werden, oder wenn optische Linsen von statischen Aufladungen befreit werden sollen.
Die Zündstifte der Firestone-Zündkerzen enthielten um 1940 in den USA das radioaktive Schwermetall. Es sollte die Luft ionisieren und damit die Dauer des Zündfunkens verlängern.
210Po entwickelt 140 Watt Wärme pro Gramm[9], weshalb es historisch auch in kurzlebigen Radionuklidbatterien eingesetzt wurde, wie z. B. in frühen Satelliten.[10] Die Wärmeleistung genügt, um einen Poloniumkörper zum Schmelzen zu bringen.[11] Heute kommen i. A. nur noch langlebigere Isotope anderer Elemente zum Einsatz.
Auch in Kernwaffen wurde Polonium als Neutronenquelle eingesetzt. So wurden zum Beispiel in den amerikanischen Atombomben Little Boy und Fat Man, die auf Hiroshima und Nagasaki abgeworfen wurden, Initiatoren aus Polonium und Beryllium zum Start der Kettenreaktion verwendet.
Verbindungen
Sauerstoffverbindungen
Poloniumdioxid, (PoO2)x, ist wie das Oxid des Gruppennachbarn Tellur (Tellurdioxid, (TeO2)x) eine ionische Verbindung, die in einer gelben und einer roten Modifikation auftritt. Weiterhin kennt man Poloniumtrioxid (PoO3).
Sulfide
Schwarzes Poloniumsulfid (PoS) erhält man durch Fällung von in Säure gelöstem Polonium mit Schwefelwasserstoff.
Wasserstoffverbindungen
Poloniumwasserstoff (H2Po) ist eine bei Raumtemperatur flüssige Wasserstoff-Verbindung, von der sich zahlreiche Polonide ableiten lassen.
Halogenide
Poloniumhalogenide kennt man mit den Summenformeln PoX2, PoX4 und PoX6. Zu nennen sind Poloniumdifluorid, Poloniumdichlorid (rubinrot), Poloniumdibromid (purpurbraun) und Poloniumtetrafluorid, hellgelbes Poloniumtetrachlorid, rotes Poloniumtetrabromid, schwarzes Poloniumtetraiodid sowie das weiße, leicht flüchtige Poloniumhexafluorid.
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Holleman, Wiberg; Lehrbuch der Anorganischen Chemie; 101. Auflage; S.635
- ↑ Q&A: Polonium 210
- ↑ http://atom.kaeri.re.kr/cgi-bin/nuclide?nuc=Po Polonium Daten bei KAERI (Einem koreanischen Kernforschungsinstitut)
- ↑ http://hpschapters.org/northcarolina/NSDS/210PoPDF.pdf Gefahrenhinweise zu Polonium 210
- ↑ Warum Tabak radioaktiv ist Ein Rauch wie 250 Röntgenaufnahmen — pro Jahr - Panorama - sueddeutsche.de
- ↑ http://www.qualm-nix.de/umwelt.htm
- ↑ Michael Karpin, The bomb in the basement: How Israel went nuclear and what that means for the world, Simon and Schuster, 2006, ISBN 0-7432-6594-7,
- ↑ http://www.spiegel.de/wissenschaft/mensch/0,1518,451726,00.html Polonium der strahlende Killer
- ↑ http://www.ohio.doe.gov/oh_seb/docs/isotopes.pdf Ausführlicher Bericht über Gewinnung und frühe Verwendung von Polonium (und anderen Elementen).
- ↑ Petrjanow-Sokolow (Hrsg.), Bausteine der Erde Bd. 4, Verlag Mir Moskau, Urania Verlag Leipzig, 1977, S. 15
Weblinks
- Gesundheits- und Umweltaspekte von Polonium
- Polonium bei webelements.com
- Wie Polonium im Reaktor entsteht Welt.de
- Polonium-210 - In tödlicher Mission
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.