- Positronenemissiontomographie
-
Die Positronen-Emissions-Tomographie (von altgr. τομή, tome, „Schnitt“ und γράφειν, graphein, „schreiben“), Abkürzung PET, ist ein bildgebendes Verfahren der Nuklearmedizin, das Schnittbilder von lebenden Organismen erzeugt, indem es die Verteilung einer schwach radioaktiv markierten Substanz (Radiopharmakon) im Organismus sichtbar macht und damit biochemische und physiologische Funktionen abbildet (funktionelle Bildgebung).
Inhaltsverzeichnis
Prinzip
Basierend auf dem Prinzip der Szintigrafie wird dem Patienten zu Beginn einer PET-Untersuchung ein Radiopharmakon verabreicht, meist durch Injektion in eine Armvene. Die PET verwendet Radionuklide, die Positronen emittieren (Betastrahlung). Bei der Wechselwirkung eines Positrons mit einem Elektron im Körper werden zwei hochenergetische Photonen in genau entgegengesetzte Richtungen, also mit dem Winkel 180 Grad zueinander, ausgesandt (Vernichtungsstrahlung). Das PET-Gerät enthält viele, ringförmig um den Patienten angeordnete Detektoren für die Photonen. Das Prinzip der PET-Untersuchung besteht darin, Koinzidenzen zwischen je zwei genau gegenüberliegenden Detektoren aufzuzeichnen. Aus der zeitlichen und räumlichen Verteilung dieser registrierten Zerfallsereignisse wird auf die räumliche Verteilung des Radiopharmakons im Körperinneren geschlossen und eine Serie von Schnittbildern errechnet. Häufige Anwendung findet die PET bei stoffwechselbezogenen Fragestellungen in der Onkologie, Neurologie sowie Kardiologie.
Im Gegensatz zur SPECT kann bei der PET durch das Meßprinzip des Koinzidenznachweises auf eine physikalische Kollimation verzichtet werden. Bei der SPECT wird der Kollimator für die Bestimmung der Einfallsrichtung der Photonen benötigt. Der Wegfall der Kollimation bei der PET führt zu deutlich verbesserter Ausbeute, höheren Zählraten und somit zu verbesserter Bildstatistik mit höherer Bildqualität und gesteigerter räumlicher Auflösung.[1]
PET/CT-Geräte für die Diagnostik am Menschen in Forschung und Klinik werden von den Firmen General Electric, Philips und Siemens angeboten.
Radionuklide
Das meist verwendete Nuklid in der PET ist das radioaktive Isotop des Fluor (18F). Es wird mit Hilfe eines Zyklotrons hergestellt und kann aufgrund seiner Halbwertszeit von etwa 110 Minuten über weite Strecken transportiert werden. Es kommt aus diesem Grund bei über 90 % aller PET-Untersuchungen zum Einsatz.
Nuklid Halbwertszeit 11C 20,3 Minuten 13N 10,1 Minuten 15O 2,03 Minuten 18F 110 Minuten 68Ga 68 Minuten 82Rb 75 Sekunden Neben 18F werden hauptsächlich 11C, 13N, 15O, 82Rb oder 68Ga eingesetzt.[2] Dies sind radioaktive Isotope der Elemente Kohlenstoff, Stickstoff, Sauerstoff, Rubidium und Gallium.
68Ga und 82Rb sind Generator-Radioisotope. Das Radioisotop entsteht hier durch Zerfall eines instabilen Mutterisotops in einem sogenannten Nuklidgenerator, in dem es sich anreichert (→Gallium-68-Generator). Alle anderen genannten PET-Nuklide werden mit Hilfe eines Zyklotrons hergestellt.
Das verwendete Radionuklid hat Einfluss auf die kritischen Leistungsparameter des PET-Gerätes: Während kurzlebige Nuklide verlangen, dass der PET-Scanner die damit einhergehenden hohen Zählraten bei Aktivitäten von mehreren Gigabecquerel (GBq) verarbeiten kann, ist bei Fluordesoxyglucose die Sensitivität des Systems gefordert, da die injizierte Dosis hier meist nur zwischen 200 und 400 Megabecquerel (MBq) liegt.
Die Bedeutung der Halbwertszeit soll anhand einer Rechnung erläutert werden: Nach 60 Minuten ist von einer Anfangsaktivität von 1000 MBq 11C nur etwa ein Achtel übrig. 60 Minuten sind bei einem Radiopharmakon auf 11C-Basis ungefähr drei Halbwertszeiten (exakt: 60/20,3 = 2,956). In diesem Beispiel ist die Restaktivität nach einer Stunde = 1000 MBq x 1/22,956 = 128 MBq. Die Verwendung von 11C erfordert daher, dass sich ein Zyklotron in relativer Nähe des PET-Systems befindet. Werden 13N oder 15O eingesetzt, muss sich das Zyklotron in unmittelbarer Nähe des PET-Scanners befinden. Ein radiopharmazeutischer Produktionsbetrieb mit Zyklotron erfordert eine Investition im zweistelligen Millionenbereich, was die Nutzung der genannten Nuklide für die PET stark einschränkt.
Radiopharmaka
Radiopharmaka (im Zusammenhang mit PET auch Tracer genannt) sind Substanzen, die mit einem Radionuklid markiert sind. Der Organismus kann sie nicht von ihren nichtradioaktiven Pendants unterscheiden, daher gehen sie in den gewöhnlichen Stoffwechsel ein. Aufgrund seines radioaktiven Zerfalls kann das Radionuklid im Körper aufgespürt werden.
Anreicherungsmechanismus
18F-Fluordesoxyglucose (FDG) wird von Zellen genauso aufgenommen wie Glukose, obwohl an einer Stelle des Moleküls eine Hydroxylgruppe durch das Radionuklid 18F ersetzt ist. Da FDG-6-phosphat nach der Phosphorylierung nicht weiter verstoffwechselt wird, findet eine Anreicherung statt. Die Verteilung von FDG im Körper erlaubt somit Rückschlüsse auf den Glukosestoffwechsel verschiedener Gewebe. Dies ist besonders für die frühe Diagnose von Krebserkrankungen von Vorteil, da Tumorzellen aufgrund eines erhöhten Stoffwechsels meist viel Glukose verbrauchen und sich FDG daher dort anreichert. Das Anreicherungsprinzip anderer Radiopharmaka gehorcht demselben Mechanismus: wo immer der Körper eine dem Radiopharmakon ähnliche Substanz verstoffwechselt, wird die Substanz metabolisiert, das Radiopharmakon jedoch angereichtert und damit im PET-Bild sichtbar.
Typische Anwendungsgebiete ausgewählter Radiopharmaka
Nuklid Radiopharmakon Anwendungsgebiet 11C [11C]-Cholin Prostatakrebsdiagnostik[3] [11C]-Pittsburgh compound Pittsburgh compound B zur Alzheimer Frühdiagnostik (noch in Entwicklung)[4] [11C]-S-Methyl-L-Methionin Sichtbarmachung der Proteinsynthese Acetat Visualisierung des Sauerstoffverbrauchs des Herzmuskels 13N L-Glutaminsäure Darstellung des Aminosäurenstoffwechsels Ammoniak Darstellung der Herzmuskeldurchblutung 15O Wasser Darstellung der Durchblutung (Perfusion) [15O2] Darstellung der Sauerstoffaufnahme und Verteilung 18F [18F]-Fluoruracil Darstellung von Tumoren und für die Therapiekontrolle [18F]-Fluorid Darstellung des Knochenstoffwechsels [18F]-Fluor-2-Desoxy-D-Glukose Darstellung von Glukosetransport und Glukoseumsatz [18F]-6-Fluoro-DOPA Darstellung des präsynaptischen Dopamin-Pools 68Ga DOTATOC Somatostatin-Rezeptorbildgebung neuroendokriner Tumoren: Pankreastumor, Meningiom, kleinzellige Bronchialkarzinom oder Karzinoid[5] 82Rb [82Rb]-Chlorid Darstellung der Herzmuskeldurchblutung Die PET-Untersuchung
Indikationen
Wegen der hohen Kosten und zum Strahlenschutz sollen PET-Untersuchungen nur bei nachgewiesenem Nutzen durchgeführt werden. Für welche Indikationen eine PET sinnvoll ist, wird beispielsweise von der Deutschen Gesellschaft für Nuklearmedizin detailliert bewertet.[6] International akzeptierte Indikationen sind gegenwärtig[7][8]
Krankheit Kostenübernahme für Solitärer Lungenrundherd Charakterisierung nicht kleinzelliges Bronchialkarzinom Charakterisierung Oesophaguskarzinom Primärstaging, Diagnose, Staging, Re-Staging Kolorektales Karzinom Diagnose, Staging und Re-Staging steigender CEA-Wert Tumorlokalisation Lymphom Diagnose, Staging und Re-Staging Melanom Diagnose, Staging und Re-Staging Mammakarzinom Restaging, Therapieverlaufs- oder Diskussion einer
Therapieregimeänderung beim metastasierten Mammakarzinom
Kopf- und Halstumoren Diagnose, Staging und Re-Staging follikuläres Schilddrüsenkarzinom Re-Staging des Rezidivs oder Resttumors Basalganglienerkrankungen frühe Differenzialdiagnose des Morbus Parkinson,
frühe Diagnose von Multisystemdegenerationen,
Früherkennung der Huntingtonschen ErkrankungDemenz Frühdiagnostik der primären Demenzen Epilepsie Lokalisation des epileptogenen Fokus im Rahmen der präoperativen
Epilepsiediagnostik bei Temporallappenepilepsien (mit F-18-FDG)
Ablauf
Der Proband erhält das Radiopharmakon per Injektion oder Inhalation. Im Falle einer FDG-PET-Untersuchung werden je nach Patientengewicht 200 bis 700 MBq injiziert;[9] anschließend muss der Patient etwa 50 bis 75 Minuten[9] ruhen, damit der Tracer genügend Zeit hat, sich an relevanten Stellen im Körper anzureichern (Uptakephase). Bei der FDG-PET soll der Patient zum Zeitpunkt der Untersuchung nüchtern sein. Während der Untersuchung soll er ruhig liegen und nicht frieren, da sonst die Erhöhung des Zuckerstoffwechsels als Anreicherung in Muskulatur und braunem Fettgewebe sichtbar würde. Bei der Untersuchung wird der Patient auf einem beweglichen Tisch so positioniert, dass der zu untersuchende Körperabschnitt im Sichtbereich der Detektoren liegt. Der axiale Sichtbereich der Detektoren – auch Field of View (FOV) genannt – liegt bei kommerziellen Systemen im Bereich von etwa 15 bis 20 cm. Bei Aufnahmen, die einen größeren Teil des Körpers abdecken, ist es daher nötig, mehrere sogenannte Bettpositionen aufzunehmen. Je nach Gerätetyp ist die Überlappung der Bettpositionen unterschiedlich groß und liegt zwischen circa 1,5 und 5 Zentimetern. Für eine Ganzkörperaufnahme ergeben sich daher etwa 8 bis 12 Bettpositionen. Meist werden jedoch nur Teilkörperaufnahmen durchgeführt. Pro Bettposition liegt die Aufnahmedauer je nach Gerät, verwendetem Tracer, injizierter Dosis und Körpergewicht des Patienten bei zwei bis vier Minuten. Nach Ablauf dieser Zeit fährt das Gerät automatisch zur nächsten Bettposition.
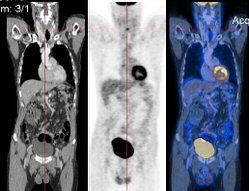
Beim PET/CT wird der Patient unmittelbar hintereinander durch beide Detektorringe (Gantries) von CT und PET gefahren. Diese Gantries sind bei einigen Systemen im selben Gehäuse untergebracht und nicht einzeln von außen sichtbar. Die entstehenden Bilder werden im Computer automatisch fusioniert.
Bei PET/CT-Geräten ist die CT-Aufnahme für die Berechnung schwächungskorrigierter PET-Bilder zwingend erforderlich, jedoch reicht ein so genannter Low-Dose CT-Scan hierfür aus. Bei einigen Geräten kann für die Errechnung der Schwächungsmap jedes CT-Protokoll, also auch eine diagnostische CT-Aufnahme genutzt werden; einige Geräte fordern zwingend die zusätzliche Durchführung eines dedizierten Low-Dose Scans, selbst wenn vom Patienten bereits eine Hoch-Dosis-CT-Aufnahme existiert.
Befundung
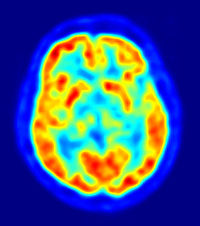
 Maximum Intensity Projection (MIP) einer 18F-FDG-Ganzkörperaufnahme. Die roten Bereiche zeigen eine hohe, die blauen eine sehr niedrige Aufnahme von FDG an.
Maximum Intensity Projection (MIP) einer 18F-FDG-Ganzkörperaufnahme. Die roten Bereiche zeigen eine hohe, die blauen eine sehr niedrige Aufnahme von FDG an.Die Befundung des PET- oder PET/CT-Bildes erfolgt durch Betrachtung der rekonstruierten Schnittbilder (axial, koronar oder sagittal). Bei PET/CT-Geräten ist die Darstellung von PET und CT verknüpft, so dass automatisch die Position des korrelierenden PET-Bildes gezeigt wird, wenn der Bildkursor im CT-Bild verschoben wird. Für eine Übersichtdarstellung wird ein sogenanntes MIP-Bild (Maximum Intensity Projection) herangezogen. In dieser Darstellung ist das gesamte Untersuchungsobjekt abgebildet und man erlangt einen schnellen Überblick über Regionen erhöhten Uptakes. Zur nochmals besseren Visualisierung kann man das MIP um sich selbst rotieren lassen, um das Untersuchungsvolumen von allen Seiten zu zeigen.
Die Quantifizierung von Regionen mit gesteigertem Uptake erfolgt über den so genannten Standard Uptake Value (SUV). Der SUV-Wert beschreibt die Nuklid-Anreicherung unter Berücksichtigung von Nuklid-Zerfall, verabreichter Dosis und Patientengewicht, um damit eine zeit- und gewichtsunabhängige Quantifizierung zu erhalten. Die Traceranreicherung ist im Falle von FDG vom Blutzuckerwert des Patienten abhängig; der SUV-Wert ist auch vom PET-System abhängig, auf dem die Untersuchung durchgeführt wurde, so dass Messwerte von zwei verschiedenen Systemen nicht vergleichbar sind. Bei der Beurteilung einer Anreicherung muss zwischen physiologischem und pathologischem Uptake unterschieden werden. Ein pathologischer Uptake kann ganz unterschiedliche Ursachen haben: Ein Tumor kann ebenso zu einer FDG-Anreicherung führen wie der Heilungsprozess einer Wunde oder ein Entzündungsvorgang.[9]
Die sogenannte total lesion glycolysis (TLG) wird vom SUV abgeleitet, es ist der mittlere SUV-Wert * Tumorvolumen und beschreibt im Gegensatz zum SUV nicht den maximalen oder mittleren Glukoseumsatz an einer bestimmten Stelle, sondern den Glukoseumsatz der gesamten Läsion.[10]
Strahlenexposition
Da PET auf der Verabreichung einer radioaktiven Substanz beruht, muss die Indikation wie bei allen mit ionisierender Strahlung arbeitenden Bildgebungsverfahren (z. B. CT, Angiografie) zurückhaltend gestellt werden.
Die Strahlenexposition einer reinen PET-Untersuchung mit [F-18]FDG liegt bei etwa 4 mSv[11] und damit in der Größenordnung einer Computertomografie des Thorax. Wie bei allen Untersuchungsverfahren mit ionisierenden Strahlen muss auch bei der PET die Strahlenmenge in Relation zu der gewonnenen Information gesetzt werden. Es ist bei einer Strahlendosis von 1 Sievert (Sv), der 100 Menschen ausgesetzt sind, mit 5 Todesfällen durch Strahlenkrebs zu rechnen, für über 60-Jährige gilt ein Wert von 1,2 Todesfällen pro Sv. Man müsste also 100.000 PET-Untersuchungen durchführen, um 35 Todesfälle an Strahlenkrebs (nach einer mittleren Latenzzeit von etwa 15 Jahren für Leukämie und etwa 40 Jahren für solide Tumoren) zu verursachen, das heißt etwa eine auf 3000 Untersuchungen. Dabei ist zu berücksichtigen, dass die Mehrzahl der PET-Untersuchungen bei onkologischen Fragestellungen erfolgt, also bei Patienten mit zum Teil erheblich eingeschränkter Lebenserwartung.
Als Beispiel: eine PET-Untersuchung erfolgt zum Staging bei einem Patienten mit nicht-kleinzelligen Bronchialkarzinom (Fünf-Jahres-Überlebensrate von 5 bis 10 %[12]). Hier ist das theoretische Risiko für den Patienten, 20 oder 30 Jahre später an einem strahleninduzierten Zweittumor zu erkranken, völlig zu vernachlässigen. Dahingegen führt die PET-Untersuchung in 11 bis 37 % der Fälle bei dieser Erkrankung zu einer wesentlichen Änderung und damit i.d.R. zu einer Verbesserung des therapeutischen Vorgehens.[13]
Kosten und Kostenübernahme
PET gehört zu den teuersten bildgebenden Verfahren in der modernen Medizin. Die Kosten einer PET-Untersuchung können bis zu 1.500 € betragen.[14] Eine Ganzkörper-PET/CT kostet in Deutschland beispielsweise 1123 Euro (Stand: April 2008). Dies ist gegenüber einer Ganzkörper-MRT mit 575 Euro etwa der doppelte Preis.[15] Die reinen Gerätekosten für ein PET-Gerät liegen je nach Ausstattung zwischen 1,5 und 3 Mio. Euro.[14]
Ein großer Teil der für die Diagnostik notwendigen Radiopharmaka müssen mittels eines Zyklotrons hergestellt werden und verursachen beim produzierenden Betrieb somit hohe Kosten. Da die Produktion von Radiopharmaka dem Arzneimittelgesetz unterliegt, kommen sämtliche Auflagen und Gesetze zur Anwendung, denen ein Arzneimittel herstellender Betrieb unterliegt, so dass die Gesamtinvestitionen für die Produktion von Radiopharmaka bei ca. 10 Mio Euro liegen.
Die Gesetzliche Krankenversicherung in Deutschland übernimmt die Kosten für eine PET-Untersuchung im Gegensatz zur Praxis in anderen europäischen Staaten in der Regel nur, wenn der Patient stationär aufgenommen bzw. behandelt wird. Hier ist jedoch zu berücksichtigen, das der medizinische Dienst der Krankenkassen immer häufiger eine Kostenübernahme ablehnt, wenn der Patient nur zur Durchführung einer PET/CT stationär aufgenommen wurde, d. h. keine andere Diagnostik durchgeführt wurde oder bereits direkt im Anschluss mit der Therapie begonnen wurde. Seit 2007 werden in Deutschland die Kosten einer PET-Untersuchungen für die Diagnostik des nichtkleinzelligen Lungenkarzinoms (NSCLC) von den gesetzlichen Krankenkassen übernommen, jedoch existieren noch keine EBM-Ziffern, so dass die routinemäßige Abrechnung sich immer noch schwierig gestaltet. Seit 1. Januar 2009 ist zum NSCLC auch das kleinzellige Lungenkarzinom (SCLC) hinzugekommen. Der gemeinsame Bundesausschuss hat für den Fall eines unklaren Restumors die 18F-FDG PET /CT als Regelleistung im ambulanten Bereich der gesetzlichen Krankenkassen eingeführt.[16]
Bildentstehung
Trifft ein durch Zerfall des Radionuklids entstandenes Positron auf ein Elektron, werden beide vernichtet (Annihilation). Es entstehen zwei hochenergetische Photonen (Gammastrahlung) einer Energie von exakt 511 keV, die sich in einem Winkel von knapp 180° voneinander entfernen. Diese Vernichtungsstrahlung trifft gleichzeitig (koinzident) zwei Detektoren, was Nachweis und Ortsbestimmung der Positronenemission ermöglicht. Werden zwei γ-Quanten einer Energie von 511 keV zeitgleich nachgewiesen (typische Zeitfenster der Nachweiselektronik: 4,5 bis 15 Nanosekunden), wird dies als Positron-Elektron-Vernichtung auf der gedachten Linie zwischen den signalgebenden Detektoren interpretiert (sogenannte Line Of Response (LOR) bzw. Koinzidenzlinie).
PET-Detektor
Die Energie der nachzuweisenden Vernichtungsstrahlung ist mit diskret 511 keV größer als die Maximalenergie des in der Röntgendiagnostik verwendeten Röntgenspektrums (bis zu 150 keV in der Computertomographie). Die Wechselwirkungswahrscheinlichkeit mit Materie ist daher vergleichsweise gering. Diese, unter Strahlenschutzaspekten positive Eigenschaft, erschwert aber deren Nachweis und damit die Bildgebung. Detektoren für die PET könnten zwar auch in Halbleitertechnik realisiert werden, gegenwärtig werden jedoch in allen klinischen PET eine Kombination aus Szintillationskristall und Photomultiplier verwendet.
Der ideale PET-Detektor
Den idealen PET-Detektor gibt es nicht. Wünschenswert sind folgende Eigenschaften:
- Er umschließt das Untersuchungsobjekt vollständig.
- Er absorbiert alle einfallenden Photonen vollständig.
- Er registriert exakt die Position der einfallenden Photonen.
- Er ist nach Detektion eines Koinzidenzereignisses sofort in der Lage, das nächste Ereignis zu registrieren (möglichst geringe Totzeit).
- Er verliert auch bei höchsten Zählraten nicht seine Leistungsfähigkeit.
- Die Nachweiselektronik des Detektors bestimmt den Zeitpunkt der Annihilation so präzise, dass sie über die Flugzeitdifferenz der Annihilations-Photonen den genauen Aufenthaltsort des Positrons zum Zeitpunkt der Annihilation bestimmen kann.
- Das Koinzidenzzeitfenster ist so klein, dass Randoms keine Rolle spielen.
- Der Detektor kann die Einfallsrichtung der Photonen bestimmen; Randoms werden damit stark verringert, da die Zahl der in Frage kommenden Detektoren für das korrespondierende zweite Photon stark eingeschränkt wird.
Ein ideales Material für den Szintillator des PET-Detektors gibt es nicht. Wünschenswert sind folgende Eigenschaften:[17]
- Hoher linearer Schwächungskoeffizient µ für eine hohe Sensitivität
- Hohe Photofraktion, da nur Photoelektronen, nicht aber Compton-Photonen nachgewiesen werden.
- Kurze Abklingzeit der Szintillation für geringe Zahl von Zufallskoinzidenzen bei hohen Zählraten
- Lichtstarke Szintillation für gute Energieauflösbarkeit im Photomultiplier
- Gute Energieauflösung des Detektormaterials für klare Unterscheidbarkeit zur Streustrahlung
- Wellenlänge der Szintillation in der Nähe von 400 nm für gute Nachweisbarkeit in den Photomultipliern
- Transparent für Photonen der Szintillationswellenlänge
- Brechzahl in der Nähe von 1,5 für guten Lichtübergang vom Kristall zum Photomultiplier
- Strahlungsfest für stabile Leistung bei hoher Dosisbelastung
- Nichthygroskopisch für einfache Packung
- Preiswert in der Herstellung
- Robust für einfache Handhabung und kleinere Kristallabmessungen
- Gleichbleibende Empfindlichkeit für geringen Rekalibrationsaufwand
Der reale PET-Detektor
- Geometrie
In der Anfangszeit der PET wurden Systeme hergestellt, bei denen die Koinzidenzen zwischen Teilringen oder zwischen den Köpfen einer in Koinzidenz geschalteten Doppelkopf-Gammakamera mit NaJ-Szintillator gemessen wurden. Die Empfindlichkeit dieser Systeme war Vollring-PET-Systemen jedoch so stark unterlegen, dass sie sich nicht durchsetzen konnten.
Die ersten Vollring-PET hatten nur einen Detektor-Ring, bei modernen Systemen werden heute mehrere Ringe nebeneinander angeordnet, wodurch die Sensitivität des Gesamtsystems gesteigert wurde.
Der Detektor eines heute erhältlichen PET-Scanners besteht aus mehreren Detektorringen, die jeweils aus 30–40 Detektormodulen aufgebaut sind. Ein Detektormodul besteht aus 4–8 Detektorblöcken. Ein Detektorblock besteht aus mehreren Einzelkristallen (z. B. in der Anordnung 4×4, 4×5 oder 6×6). Die Abmessungen der Kristalle bewegen sich im Bereich von 6 bis 8 mm in transaxialer Richtung. In radialer Richtung - also in Einfallsrichtung der Photonen - beträgt die Kristalldicke meist zwischen 20 und 30 mm.
In der Summe ergibt dies ca. 10.000 ringförmig angeordnete Detektorkristalle (Szintillationszähler), die mit ca. 1000 Photomultipliern gekoppelt sind.
Der axiale Sichtbereich der Detektoren - auch Field of View (FOV) genannt - liegt im Bereich von ca. 15 bis 20 cm. Der Durchmesser des Detektor-Ringes liegt je nach Gerät zwischen ca. 50 und ca. 85 cm.
- Kristallmaterial
Alle Systeme für die klinische PET benutzen heute als Detektormaterial entweder Bismutgermanat „BGO“ (Bi4Ge3O12), mit Ce3+ dotierte Verbindungen wie Lutetiumyttriumoxoorthosilicat („LYSO“, LuYSiO5:Ce3+) oder Lutetiumoxyorthosilicat („LSO“, Lu2SiO5:Ce3+).
Die kürzere Abklingzeit von LSO und LYSO ermöglicht, PET-Systeme mit deutlich kleineren Koinzidenzzeitfenstern zu bauen, als dies mit dem Kristallmaterial BGO möglich ist. Ein kleineres Koinzidenzzeitfenster verringert die Zahl der gemessenen Zufallskoinzidenzen und verbessert auf diese Weise das Signal-Rausch-Verhältnis. LSO und LYSO sind jedoch (gegenwärtig) in der Herstellung deutlich teurer als BGO. Sensitivität und Photofraktion von BGO sind größer als die von LSO und LYSO. Der Bau eines Time-of-Flight-PET-Systems, an dem seit den 1980er Jahren geforscht wird, ist mit BGO nicht möglich. Die für die TOF nötige zeitliche Auflösung ist hiermit nicht zu erreichen. Das gegenwärtig einzige kommerziell erhältliche TOF-PET-System verwendet LYSO als Kristallmaterial. Bis vor einigen Jahren wurde von einem Hersteller auch Gadoliniumorthosilicat (GSO) als Detektormaterial verwendet.
- Szintillationsnachweis
Die Szintillationskristalle werden entweder eingesägt oder mehrere Kristalle werden miteinander verklebt. An den Kristallgrenzen kommt es zur Reflexion der Photonen, die so in Richtung der Photomultiplier gelenkt werden. Dies ermöglicht eine genauere Lokalisation als in einem homogenen, einzelnen Kristallblock. In allen klinischen PET-Systemen werden Photomultiplier verwendet, da es (zur Zeit) die empfindlichsten Nachweisinstrumente für die sehr schwachen Lichtblitze sind. Mehrere Photomultiplier "blicken" zusammen auf eine Gruppe von Szintillationskristallen und sind entweder direkt oder via Lichtleiter mit dem Szintillationskristall verbunden. Die Lokalisation der Szintillationen erfolgt nach dem Prinzip der Anger-Kamera durch Wichtung der Helligkeit der in den Photomultipliern registrierten Szintillationen. Die Photomultiplier haben je nach Hersteller runde oder quadratische Eintrittsfenster.
Wunsch und Wirklichkeit: Was will man messen und was wird gemessen?
Koinzidenzstrahlung kann auf dem Weg in die Detektoren gestreut und absorbiert werden. Kein Detektor hat eine einhundertprozentige Nachweisempfindlichkeit. Detektoren benötigen für die Messung Zeit und auch ein noch so kleines Zeitfenster ist kein Garant dafür, nur koinzidente Ereignisse zu erfassen.
Im Folgenden wird beschrieben, welche Effekte bei Zählung und Lokalisation der Koinzidenzstrahlung auftreten und mit welchen Aufnahme-, Korrektur und Rekonstruktionsverfahren versucht wird, die Bildqualität verschlechternde Einflüsse gering zu halten:[18]
- Wahre Koinzidenzen („Trues“)
Ziel der PET ist es, ausschließlich „Trues“ zu messen. Ein True liegt vor, wenn zwei entstandene Photonen das Untersuchungsvolumen ohne Wechselwirkung (Streuung) durchqueren konnten und ihre volle Energie in den Detektoren deponiert haben, die im Anschluss von der Messelektronik auch erkannt wurden. Die Voraussetzungen, dass ein True gemessen werden kann, sind:
- Die Flugrichtung beider Photonen liegt im Sichtbereich der Detektoren.
- Keines der Photonen hat durch Streuung (im Patienten) zu viel Energie verloren, so dass beide nachgewiesen werden.
- Keines der Photonen ist durch Absorption verschwunden.
- Die Detektoren des Systems sind empfindlich genug, um sie nachzuweisen.
- Die Detektoren des Systems sind zum Zeitpunkt der Szintillation nicht durch vorangegangene Ereignisse blockiert (sogenannte Totzeit).
Es ist klar, dass es Ziel guten Gerätedesigns sein muss, eine hohe Zahl von Trues zu erhalten. Je höher die Zahl der Trues bei einer bestimmten Aktivität ist, desto sensitiver ist der PET.
Die Zahl der Trues kann erhöht werden durch:
- Erhöhung der applizierten Nukliddosis: Dies erhöht jedoch auch die Zahl der Singles und somit auch der Randoms.
- geringer Patientendurchmesser, was auch die Streuung der Photonen (Scatter) verringert
- Erhöhung der Aufnahmedauer
- großer vom Detektor abgedeckter Raumwinkel
- Die Detektoren besitzen einen engen Messbereich um die erwartete Energie
- hohe Nachweisempfindlichkeit des Detektorkristalls
- hohe Nachweisempfindlichkeit der Detektorelektronik
Mit steigender Zählrate gewinnt die Totzeit von Detektorkristall und Detektorelektronik an Bedeutung, da mit zunehmender Aktivität die Wahrscheinlichkeit steigt, dass einem registrierten Koinzidenzereignis unmittelbar darauf ein weiteres folgt.
- Einzelereignisse („Singles“)
Singles gehören zu den unerwünschten Ereignissen. Sie entstehen, wenn nur eines der beiden entstandenen Photonen nachgewiesen werden kann. Der Grund für den Nachweisverlust des zweiten Photons kann sein:
- Eines der beiden Photonen verlässt den „Sichtbereich“ der Detektoren (Field-of-View, FOV)
- Eines der beiden Photonen wird im Untersuchungsvolumen (Patient) gestreut. Die damit verbundene Richtungsänderung führt unter Umständen dazu, dass das Photon den FOV des Detektors verlässt. Ein Photon verliert durch Streuung jedoch an Energie: wenn es nach der Streuung noch auf einen Detektor trifft, wird es verworfen, wenn seine Restenergie die untere Energieschwelle des Detektors unterschreitet.
- Eines der beiden Photonen wird im Untersuchungsvolumen (Patient) absorbiert.
- Eines der beiden Photonen kann den Detektor durchdringen oder deponiert nur einen Teil seiner Energie im Detektor; das Photon wird in diesem Fall als Streuphoton interpretiert und verworfen.
- Eines der beiden Photonen trifft auf einen Detektor, der zu dieser Zeit mit der Verarbeitung eines vorangegangenen Impulses beschäftigt ist. Die Messelektronik ist nicht in der Lage, zwei gleichzeitige oder fast gleichzeitige Impulse zu erfassen und verwirft die zweite oder beide Szintillationen.
Wird ein Single als solches erkannt, wird es verworfen und trägt nicht zur Bildentstehung bei.
- Zufallskoinzidenzen („Randoms“)
Randoms gehören zu den unerwünschten Ereignissen. Werden zwei Szintillationen in zwei in Koinzidenz geschalteten Kristallen innerhalb des Koinzidenzzeitfensters detektiert, werden sie als Annihilation interpretiert.
Es ist jedoch möglich, dass zwei Singles registriert werden, die an verschiedenen Orten im Untersuchungsvolumen zufällig zur selben Zeit entstanden sind. Dies wird dann ebenso – in diesem Fall jedoch fälschlicherweise – als Annihilation interpretiert und geht in die Bildrekonstruktion ein.
Die Entstehungswahrscheinlichkeit von Zufallskoinzidenzen (Randoms) lässt sich verringern durch:
- eine niedrige applizierte Nukliddosis,
- ein kleines Koinzidenzzeitfenster,
- eine große Zahl von Detektoren,
- durch Verringerung der Zahl der gemessenen Singles (z. B. durch Verwendung von Septen = 2D Aufnahmemodus)
Die Zahl der gemessenen Randoms steigt mit steigender Zahl an Singles stark an.
- Gestreute Koinzidenzen („Scatter“)
Scatter gehört zu den unerwünschten Ereignissen. Wird ein Photon auf dem Weg zum Detektor gestreut, so ändert es seine Richtung. Da der Ortsbestimmung im PET jedoch immer eine gerade Strecke zwischen zwei zeitgleich aufgetretenen Ereignissen zugrunde liegt, führt dies zu einer Fehllokalisation. Durch die Streuung verliert ein Photon jedoch an Energie. Scatter kann somit ausgeblendet werden, indem eine Szintillation nur dann gezählt wird, wenn sie im Detektor eine bestimmte Energieschwelle überschreitet. Die Verwendung einer unteren Energieschwelle ist daher eine wirkungsvolle Methode zur Unterdrückung gestreuter Koinzidenzen. Allerdings wird dieser Ansatz durch die endliche Energieauflösung des Detektors begrenzt.
Scatter kann jedoch auch durch Einsatz von Trennwänden („Septen“) bzw. Endshields verringert werden; hierbei gelangen gestreute Photonen, die nicht dem Messvolumen entstammen, gar nicht erst zum Detektor.
Der Übergang von 2D- zu 3D-Akquisitionen in der klinischen Praxis und der damit verbundene Wegfall der Septen geht mit einem stark erhöhten Anteil an Streustrahlung einher. Aus diesem Grund existieren verschiedene Ansätze, den Streustrahlungsanteil mit Hilfe von Korrekturalgorithmen zu eliminieren.[19]
Akquisitionsmodi
Wie bereits beschrieben, ist man bei der Erfassung der Koinzidenzereignisse mit einigen unerwünschten Nebeneffekten konfrontiert. Vom Detektorsystem werden sich teilweise widersprechende Leistungsparameter gefordert. Daneben bestimmt die zu klärende Fragestellung, wie die Messdaten erfasst bzw. nachverarbeitet werden. Spezielle Akquisitionsmodi wurden entwickelt, um für den jeweiligen Einsatzzweck zu optimalen Ergebnissen zu gelangen.
Standardverfahren
- Statische Datenaufnahme
Der am häufigsten angewandte Aufnahmemodus ist die Statische Aufnahme. Hierbei werden alle Ereignisse, die während einer bestimmten Zeitspanne an derselben Aufnahmeposition auflaufen, für die Bildrekonstruktion verwendet. Typischerweise werden pro Aufnahmeposition bei einer FDG-PET Koinzidenzen über eine Zeitspanne von zwei bis vier Minuten akquiriert. Je länger die Aufnahme läuft, desto größer wird die Zahl der für die Bildrekonstruktion verwendbaren Koinzidenzereignisse, was die Bildqualität im Hinblick auf das Signal-Rauschverhältnis verbessert. Eine Verlängerung der Aufnahmedauer vergrößert jedoch andererseits die Wahrscheinlichkeit von Bewegungsartefakten durch willkürliche und physiologische Bewegungen des Untersuchungsobjektes. Eine Statische Aufnahme gibt Aufschluss über die zum Aufnahmezeitpunkt im Untersuchungsvolumen angereicherte Tracermenge. Die Geschwindigkeit der Anreicherung kann damit nicht beurteilt werden, hierfür ist eine dynamische Akquisition erforderlich.
- Dynamische Datenaufnahme
Es wird nicht wie bei der statischen Aufnahme die Gesamtzahl an Koinzidenzereignissen aufaddiert, sondern der Verlauf der Aktivitätsanreicherung betrachtet. Die Geschwindigkeit, d.h. Dynamik der Anreicherung erlaubt Rückschlüsse über die Art bzw. Schwere einer Läsion. Das Dynamische Aufnahmeverfahren findet u.A. Anwendung in der Rezeptorszintigrafie (Neurologie) oder für die Beurteilung der Myokardperfusion. Eine dynamische Studie besteht aus Multiframe-Datensätzen. Im Gegensatz zur statischen Aufnahme zeigt in einem Multiframedatensatz eine Bildfolge nicht eine Abfolge verschiedener Aufnahmepositionen, sondern verschiedener Zeitfenster derselben Aufnahmeposition, z.B. Frame 1: 0-15 Sekunden, Frame 2: 15-30 Sekunden u.s.w.
- Getriggerte Datenaufnahme
Sie ist eine Sonderform der dynamischen Datenaufnahme. Atmung und Herzschlag sind Patientenbewegungen, die sich während der PET-Aufnahme nicht unterdrücken lassen. Von daher bietet sich an, mittels geeigneter Datenakquisition die damit einhergehenden Bildartefakte zu beseitigen. Bei der getriggerten Datenakquisition wird ein vollständiger Zyklus (Herzschlag oder Atmung) von einem Messsystem erfasst und die aufgenommenen Rohdaten in (z.B. 8 bis 16) Gruppen (sogenannte Gates oder Bins) unterteilt. Nach der Aufnahme werden diese zusammengefasst rekonstruiert. Das Ergebnis sind Bilder, die jeweils nur eine Phase der Bewegung (endsystolische oder enddiastolische Phase bei EKG-Triggerung, endinspiratorische oder endexpiratorische Phase bei Atemtriggerung) zeigen und keine Verwischungsartefakte vorweisen. Klinische Studien belegen den diagnostischen Mehrwert des Verfahrens. Die Beurteilbarkeit der Dignität von Lungenrundherden verbessert sich nachweislich durch Anwendung der Atemtriggerung, die Qualität kardiologischer Aufnahmen durch die kombinierte EKG- und Atemtriggerung.[20][21][22]
Spezielle Aufnahmemodi
- Der 3D-Aufnahmemodus
Hier wird nicht nur auf Koinzidenzen innerhalb desselben Detektorrings, sondern auch zwischen verschiedenen Detektorringen überprüft. Der 3D-Aufnahmemodus ist der am häufigsten verwendete Aufnahmemodus. Für eine große Zahl von klinischen PET und PET/CT-Systemen ist dies der einzig verfügbare Aufnahmemodus.
Durch den größeren betrachteten Raumwinkel ergibt sich im Vergleich zum 2D-Aufnahmemodus eine erhöhte Sensitivität, da auch schräg einfallende Koinzidenzen erfasst werden.
Da im 3D-Aufnahmemodus Ereignisse einer größeren Zahl von Detektoren betrachtet werden, stellt dies größere Anforderungen an die Geräteelektronik. Der reine 3D-Modus führt überdies zu einer in axialer Richtung inhomogenen Sensitivität: In der Mitte des axialen FOV ist der Raumwinkel der erfassbaren Koinzidenzereignisse größer als am Rand, wo fast nur streng radiale Koinzidenzen gemessen werden können. Da eine Koinzidenzschaltung aller Detektoren zu allen Detektoren ohnehin nicht umsetzbar ist, wird dieser Effekt durch geschickte Gruppierung der zusammengeschalteten Detektoren verringert, kann aber nicht vollständig eliminiert werden.
Im 3D-Aufnahmemodus sind die Detektoren einer starken Streustrahlung ausgesetzt, die mit zunehmendem Untersuchungsvolumen und mit steigender Dosisleistung die Bildqualität zunehmend verschlechtert. Der Streustrahlungsanteil wächst u.a. an, weil die Weglänge eines Photons – und damit die Wahrscheinlichkeit einer Streuung/Absorption eines der beiden Photonen – bei schrägem Durchlauf durch das Untersuchungsvolumen größer ist als bei streng radialem Durchgang (hier radial: in Richtung Detektor, axial: vom Untersuchungsvolumen in Richtung Kopf/Füße des Patienten).
- Der 2D-Aufnahmemodus
Vor dem Erscheinen der LSO-basierten PET-Systeme waren alle PET-Scanner 2D-Scanner. Neben dem 3D Modus verfügen manche Geräte auch heute noch über einen 2D-Aufnahmemodus. Hierbei werden nur die Ereignisse auf Koinzidenz geprüft, die sich in Kristallen desselben Detektorringes ereignen. Man unterscheidet weiter zwischen einem „elektronischen“ und einem „echten“ 2D-Modus: Beim „echten“ 2D-Aufnahmemodus werden Wolframsepten in die Gantry eingefahren, um Photonen, die nicht streng radialen Ursprungs sind, zu stoppen. Beim „elektronischen“ 2D-Modus wird durch Verschaltung der Koinzidenzprüfung nur auf Koinzidenzen innerhalb desselben Ringes geprüft, die Strahlung selbst bleibt aber für die Detektoren „sichtbar“.
PET-Systeme mit „schnellem“ Kristall (LSO/LYSO) verfügen meist nicht über den „echten“ 2D-Aufnahmemodus. Es wird herstellerseitig argumentiert, dass das deutlich kleinere Koinzidenzzeitfenster von etwa 5 ns gegenüber etwa 10 ns bei BGO Scannern das Auftreten von Zufallskoinzidenzen wirkungsvoll unterdrückt.
Der elektronische und der "echte" 2D-Modus führen zu erstklassiger Homogenität der Sensitivität über das Field of View. Da die Detektoren nur Koinzidenzen aus radialer Richtung „sehen“, ist zudem die Wahrscheinlichkeit, dass gemessene Ereignisse Zufallskoinzidenzen sind, geringer als im 3D-Aufnahmemodus.
Das physikalische Ausblenden von schräg eintreffenden Photonen beim „echten“ 2D-Aufnahmemodus mittels Wolframsepten und Endshields verringert die Zahl der von den Detektoren „gesehenen“ Ereignisse stark; dieser Aufnahmemodus ist daher sehr effektiv für die Unterdrückung von Streustrahlung einsetzbar.
Der 2D Aufnahmemodus wird verwendet, wenn das Untersuchungsvolumen groß ist und eine große Zahl von Streuereignissen erwarten lässt sowie die injizierte Nukliddosis hoch ist, was das Auftreten von Zufallskoinzidenzen ebenso erhöht. In letzterem Fall wiegt der Verlust an Sensitivität nicht sehr schwer, da die Zählstatistik bei diesen Aufnahmen ohnehin sehr gut ist.
Durch das Ausblenden schräg einfallender Ereignisse werden naturgemäß nicht nur unerwünschte Streuereignisse, sondern auch echte Koinzidenzen von den Detektoren fern gehalten. Die Sensitivität des Scanners im 2D-Modus beträgt nur etwa 20 % von der des 3D-Modus.
Die Geräte der BGO-basierten DST-E Serie der Firma General Electric waren die letzten klinischen Systeme, die noch über einen echten 2D-Modus verfügten. Das beim EANM im Herbst 2008 präsentierte, ebenfalls BGO basierte Nachfolgemodell Discovery 600 verfügt nur noch über den 3D-Aufnahmemodus. Der Hersteller ist der Ansicht, die Effekte unerwünschter Streustrahlung mit Hilfe seines iterativen Rekonstruktionsmechanismus' wirkungsvoll unterdrücken zu können.[23]
- Time of Flight TOF
Bereits seit den frühen 1980er Jahren wird an dieser Methode zur Steigerung des Signal-Rauschabstands geforscht.[24] Eine TOF-Messung misst innerhalb eines Koinzidenzfensters von etwa 6 ns die Zeitdifferenz zwischen dem Auftreffen beider Gammaquanten. Damit kann nicht nur eine Aussage über den Verlauf der Line-Of-Response getroffen werden, sondern auch die Position der stattgefundenen Annihilation auf dieser Linie bestimmt werden.
Der Gemini-TF[25] von Philips implementiert das TOF-Prinzip.[26] Philips war im Jahr 2006 der erste Hersteller, der dieses Messprinzip bei einem klinischen PET/CT-System für die Diagnostik am Menschen nutzte. Die vom Gemini-TF erzielbare zeitliche Auflösung liegt bei etwa 600 Pikosekunden und verschlechtert sich mit steigender Zählrate[26]; 600 Pikosekunden bedeuten, dass sich der Ort der Annihilation mit einer Genauigkeit von 9 cm FWHM bestimmen lässt. Bei diesen Rahmenparametern liegt die Grenze bei best möglichem Gerätedesign, kleiner Läsionsgröße und einem Patientendurchmesser von 40 cm bei 50 % Gewinn an Signal-Rauschabstand. Zum gegenwärtigen Zeitpunkt verbessert die TOF daher den Signal-Rauschabstand,[27][28] nicht aber die erzielbare Ortsauflösung. Sollten sich künftig noch kleinere zeitliche Auflösungen in der Größenordnung zweistelliger Pikosekundenwerte realisieren lassen, wird dies auch die Ortsauflösung des PET-Systems verbessern. Eine gute Implementierung dieses Verfahrens wird zudem die momentan recht aufwändigen analytischen sowie iterativen Bildrekonstruktionsverfahren vereinfachen.
Am EANM 2008 wurde von der Firma Siemens mit dem Biograph mCT ein PET/CT-System vorgestellt, bei dem die TOF-Messung ebenfalls zur Anwendung kommt.[29]
Korrektur der Messdaten
Aufgrund der erwähnten Einflüsse sind die gemessenen Daten mit verschiedenartigen Fehlern behaftet und müssen aus diesem Grund vor der Bildrekonstruktion mehrfach korrigiert werden.
- Absorptionskorrektur
Während eine Absorptionskorrektur von Emissionsdaten bei Gammakameras noch nicht die ihr zustehende Akzeptanz erfährt, ist sie bei der PET für Bildrekonstruktion und die Quantifizierung von Anreicherungen eine unverzichtbare Notwendigkeit.
Relevanz für die Bildrekonstruktion: Man stelle sich eine Nuklidanreicherung vor, die sich in der Nähe eines wassergefüllten Zylinders mit 30 cm Durchmesser befindet. Die dort zerfallenen Nuklide senden ihre Vernichtungsstrahlung in alle Raumrichtungen aus. Es sollen zwei Fälle betrachtet werden: Fall 1: Die beiden entstandenen Photonen (1) und (2) fliegen exakt tangential von der Objektoberfläche weg, weder Photon (1) noch Photon (2) durchdringt irgendeinen Teil des Zylinders. Fall 2: Photon (1) zielt radial in Richtung Zylindermitte. Naturgemäß entfernt sich Photon (2) vom Zylinder, ohne auch nur einen Teil des Zylinders zu durchdringen. Die Wahrscheinlichkeit ist groß, dass Photon (1) beim Durchlauf von 30 cm Wasser absorbiert und damit Photon (2) zu einem Single wird. Wird die Absorption der Strahlung bei der Bildrekonstruktion unberücksichtigt gelassen, sind Artefakte die Folge; die gemessene Aktivitätsverteilung stimmt ohne Absorptionsskorrektur nicht mit der tatsächlichen Verteilung überein.
Relevanz für die Quantifizierung von Anreicherungen: Die Wahrscheinlichkeit einer Absorption ist im Fall (2) unabhängig davon, ob die Annihilation an der Oberfläche oder in der Mitte des Objektes stattfand. Bei Annihilation an der Oberfläche durchläuft Photon (1) den gesamten Zylinder, Photon (2) nur Luft, bei Annihilation in der Zylindermitte durchlaufen beide Photonen den halben Zylinder, was zur selben Absorptionswahrscheinlichkeit führt. Da die Absorptionswahrscheinlichkeit somit nur von der Gesamtschwächung des durchstrahlten Volumens, nicht jedoch vom Ort der Annihilation auf der Koinzidenzlinie abhängt, ermöglicht dies eine tiefenunabhängige Quantifizierung der Nuklidanreicherung.
Absorptionskorrektur beim PET: Bei den bis ca. 2003 gebauten reinen PET-Systemen wurden die Emissionsdaten des PET mit Hilfe von Stabquellen schwächungskorrigiert.[18] Dazu wurden diese um das Untersuchungsobjekt geführt und ein Tomogramm ähnliches wie bei der Computertomographie erstellt. Dies war ein teures und zeitraubendes Verfahren. Pro Bettposition war neben der Emissionsmessung eine ca. dreiminütige Transmissionsmessung nötig. Die dafür verwendete 68[Ge]-Quelle zerfiel, was mit der Zeit nicht nur die Qualität der Schwächungskorrektur verschlechterte, sondern auch einen ständigen Kostenfaktor darstellte.
Absorptionskorrektur beim PET/CT: In heutigen PET/CT-Systemen wird die Schwächungskorrektur anhand der CT-Daten durchgeführt. Da eine Ganzkörperaufnahme mit einem modernen CT nicht länger als 30 Sekunden dauert, ist dieses Verfahren nicht nur deutlich genauer, sondern auch erheblich schneller. Mit Hilfe von Umrechnungstabellen wird einem Hounsfield-Wert im Computertomographie-Schnitt der zugehörige lineare Schwächungskoeffizient µ für Gammastrahlung der Energie 511 keV zugeordnet. Davor werden die CT-Daten jedoch segmentiert: Die gemessen Daten werden geglättet und die Hounsfield-Werte auf einen festen Schwächungswert für Wasser, Knochen und Luft auf- bzw. abgerundet. Damit wird vermieden, dass durch die Schwächungskorrektur Bildrauschen ins Bild hineingerechnet wird. Da das Computertomogramm oft unter Verwendung von Röntgenkontrastmittel aufgenommen wird, kann dies bei manchen Geräten zu Bildartefakten führen. Ein Metallimplantat kann ebenso nicht nur die Bildrekonstruktion des CT, sondern auch die Schwächungskorrektur und damit die Bildrekonstruktion des PET Bildes stören.
- Korrektur der Randoms
Wie beschrieben, ist die Zahl der Zufallskoinzidenen von verschiedenen Parametern abhängig und kann sehr hohe Werte annehmen; daher muss von der gemessenen Zählrate die der Randoms abgezogen werden. Es gibt zwei verschiedene Verfahren, die Rate der Zufallskoinzidenzen zu messen:
- Entweder man misst die Zahl der Singles und errechnet aus ihrer Rate die zu erwartende Zahl der Randoms oder
- man misst kurz nach einer Koinzidenzmessung ein zweites gleichgroßes Zeitfenster. Da die Messung in diesem zweiten Zeitfenster nicht durch ein Koinzidenzereignis ausgelöst wurde, müssen die dort ermittelten Koinzidenzen Zufallskoinzidenzen sein.
- Totzeitkorrektur
Mit zunehmender Zählrate gewinnt die Totzeit des Messsystems an Bedeutung. Bei sehr hohen Zählraten weicht die gemessene Zählrate schließlich so stark von der realen Zählrate ab, dass diese Abweichung korrigiert werden muss, will man die Richtigkeit der Messung erhalten. Die Umsetzung ist einfach: Man erstellt eine Kalibrierreihe mit wachsender Aktivität. Diese bekannte Aktivität wird in verdünnter Form mit einem Referenzmessgerät (z.B. Bohrloch) gemessen und ein für die jeweilige Aktivität gültiger Korrekturfaktor errechnet.
- Korrektur der Streustrahlung
Streustrahlung entsteht in der Umgebung großer Aktivitäten oder in der Nähe von Objekten mit starker Schwächung. Eine Korrekturfunktion kann entweder anhand von Phantommessungen messtechnisch ermittelt oder unter Einbeziehung von Schwächungsdaten errechnet werden.[19]
- Recovery Korrektur
Auch die räumliche Auflösung des Systems bestimmt die gemessene Aktivität einer Läsion. Läsionen kleiner als die 4-fache räumliche Auflösung des Systems werden ohne diese Korrektur mit vermindertem Uptake dargestellt. Die Abweichung wird mit Hilfe eines Recovery-Koeffizienten korrigiert (Hot Spot Recovery Coeffizient HSRC und Cold Spot Recovery Coeffizient CSRC). Das Verfahren ist, bis zu einer Läsionsgröße, die der 1,5-fachen Auflösung des Systems entspricht, mit guten Ergebnissen anwendbar. Bei Läsionen, die kleiner sind, ergeben sich durch den stark vergrößerten Rauschanteil zu große statistische Fehler. Der Hot Spot Recovery Coeffizient kann auch als Test für die Systemlinearität verwendet werden.[1]
Bildrekonstruktion
Durch die Bildrekonstruktion entsteht aus den mehrfach korrigierten Messdaten das Bild, das die Grundlage für Analyse und Befundung ist.
- gefilterte Rückprojektion
Die gefilterte Rückprojektion (auch FBP für filtered Backprojection) ist ein Verfahren, das heute in erster Linie in der Computertomographie verwendet wird. In der PET wurde sie mittlerweile von den iterativen Rekonstruktionsverfahren verdrängt.
- Iterative 2D Rekonstruktion
Wie auch in der Mathematik ist dies eine Methode, bei der man sich einer Lösung durch wiederholtes Anwenden des gleichen Algorithmus' schrittweise annähert (von lateinisch iter „Schritt“). Die 2D-Verfahren heißen MLEM, OSEM oder AW-OSEM.
Alle diese Verfahren beginnen mit einer angenommenen Tracerverteilung, die mit jedem Rechendurchlauf durch Vergleich und Korrektur den tatsächlichen Gegebenheiten angenähert wird. Die Näherungsschritte sind:
- Rückprojektion der angenommenen Tracerverteilung unter Berücksichtigung der Eigenschaften des Abbildungssystems: Was würde man messen, wenn der Tracer so verteilt wäre, wie im Modell angenommen
- Bestimmung der Differenz zwischen rückprojizierten und gemessenen Daten
- Berechnung und Anwendung des aus der Differenz gewonnenen Korrekturfaktors
- Wiederholung der vorangegangenen Schritte bis ein Abbruchkriterium erreicht wird.
Wurden die zu rekonstruierenden Daten mit einer 3D-Akquisition gemessen, werden sie vorher durch Fourier Rebinning umgerechnet, so dass mit Hilfe der erwähnten 2D-Verfahren rekonstruiert werden kann.
Allen iterativen Verfahren gemein ist, dass sie sehr rechenintensiv sind. Mit einem iterativen Rekonstruktionsverfahren lässt sich prinzipiell jede beliebige Auflösung erreichen, jedoch wird dabei oft auch das Bildrauschen verstärkt und Rundungsfehler wirken sich zunehmend aus, so dass dann weitere Iterationen die Bildqualität verschlechtern.
- Iterative 3D Rekonstruktion
Iterative 3D-Verfahren gibt es noch nicht sehr lange. Schon das 2D-Verfahren benötigt etwa zehnmal soviel Rechenleistung wie die gefilterte Rückprojektion und kommt aufgrund dieser Tatsache erst seit einigen Jahren zum Einsatz.
Iterative 3D-Verfahren sind mathematisch sehr anspruchsvoll, obwohl das Grundprinzip dasselbe wie das der 2D-Rekonstruktion ist. Im Jahr 2007 wurden in der PET die 3D-Iterationsverfahren RAMLA (Philips) und Vuepoint (General Electric) eingesetzt.
Am SNM 2007 wurden mit Vue Point High Definition von der Firma General Electric und Truepoint HD (Siemens) neue iterative 3D-Rekonstruktionsverfahren vorgestellt. Vue Point High Definition verbessert das Signal-Rauschverhältnis um ca. 60% und ermöglicht Auflösungen, die unter klinischen Bedingungen unterhalb von 3,5 mm liegen. Die Besonderheit der Rekonstruktion ist, dass sie alle Korrekturen in der iterativen Schleife abarbeitet und damit Konvergenzprobleme bisheriger Iterationsverfahren löst.
Truepoint HD Rekonstruktion (Siemens) basiert auf der Point-Spread Funktion. Es werden die Abbildungseigenschaften des Detektors modelliert und korrigiert. Siemens gibt an, mit Truepoint HD unter Laborbedingungen Auflösungen von bis zu 2 mm zu erreichen.[30]
Leistungsparameter eines PET-Systems
Kritische Leistungsparameter werden immer von der Fragestellung bestimmt. Bei einer Metastasensuche muss das PET erhöhten Uptake in aktivitätsarmer wie aktivitätsreicher Umgebung darstellen können. In der Nuklearkardiologie hingegen ist die Darstellung eines verringerten Uptakes vor aktivitätsreicher Umgebung von Belang. Generell gilt: Kleine und große Areale mit von der Umgebung verschiedener Tracerverteilung müssen vom PET korrekt identifiziert und quantifiziert werden. Die folgenden Leistungsparameter beschreiben, wie gut ein System diese Anforderungen erfüllen kann.
Räumliche Auflösung
Die vom PET-System erzielbare räumliche Auflösung wird in FWHM angegeben. Sie wird von folgenden Faktoren limitiert:
- Größe der Szintillationskristalle
Je kleiner die dem Meßvolumen zugewandten Fläche der Einzelkristalle ist, desto besser ist die Auflösung des Detektorsystems. Kleinere Kristalle verringern jedoch die Sensitivität und eine größere Detektorenzahl erhöht die Systemkosten.
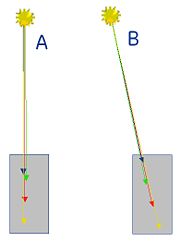
- Kollinearitätsfehler
Die Emission der Photonen erfolgt nicht exakt kollinear, sondern mit einer kleinen Abweichung zum idealen 180°-Winkel. Ursache ist, dass sich das Positronium vor der Zerstrahlung bewegt hat. Da bei der Rekonstruktion der Auftreffwinkel der Photonen üblicherweise nicht gemessen werden kann, muss zur Rekonstruktion eine Gerade als Line-of-Response (LOR) angenommen werden, wodurch bei Ganzkörper-PETs ein Fehler im Bereich einiger weniger Millimeter entsteht. Dieser so genannte Kollinearitätsfehler ist vermeidbar. Detektoren mit Messung des Eintrittswinkels für klinische PET-Systeme sind in der Entwicklungsphase und bei präklinischen PET-Systemen für Tierversuche auch schon kommerziell erhältlich. Zur Korrektur des Fehlers werden sog. Phoswich-Detektoren benutzt, bei denen zwei verschiedene Detektormaterialien quasi in Sandwich-Bauweise übereinander angeordnet sind.
- Gantrydurchmesser
ein größerer Gantrydurchmesser steigert den Einfluss des Kollinearitätsfehlers der Positronenzerstrahlung und verringert damit die maximal erreichbare Auflösung. Ein kleiner Gantrydurchmesser erhöht zwar die in der Mitte des FOV erzielbare Auflösung, führt jedoch zu unverhältnismässig starkem Absinken der Ortsauflösung außerhalb der Bildmitte: Koinzidenzen, die außerhalb des Zentrums des FOV stattfinden, treten umso schräger in die Detektoren ein, je weiter sie in radialer Richtung von der Gantrymitte entfernt sind. Der Detektor sieht dann nicht einen von vorne kommenden kompakten Lichtblitz, sondern eine Leuchtspur, deren genauer Ort nicht bestimmbar ist.
- Mittlere freie Weglänge
Die Positronen sind unmittelbar nach ihrer Entstehung zu schnell, um mit einem Elektron zu annihilieren. Sie entfernen sich daher eine kurze Strecke vom Ort ihrer Entstehung, wobei sie durch Wechselwirkung mit anderen Teilchen stetig an Energie verlieren. Die bis zur Annihilation zurückgelegte Wegstrecke ist abhängig von der mittleren Materiedichte der Umgebung und der Anfangsenergie der Positronen - und damit vom verwendeten Radionuklid. Diese sog. mittlere freie Weglänge liegt in der Größenordnung von 0,5 Millimetern im Gewebe und 1,5 Millimetern in der Lunge.[31]
- Lokalisationsgenauigkeit der Szintillation
Die Detektorgröße und die Lokalisationsgenauigkeit des Szintillationsorts mit Hilfe des Anger-Prinzips limitieren die Lokalisationsgenauigkeit einer Szintillation im Kristall auf ca. 2 mm
- Glättungsfilter
Der im Bildrekonstruktionsalgorithmus zur Verringerung von Bildrauschen verwendeter Glättungs-Filter verringert die Ortsauflösung um ca. 2-5 Millimeter
- Darstellungsmatrix
Die verwendete Darstellungsmatrix, d.h. Pixelgröße des Bildes, verringert die Auflösung des Bildes.
- Physiologische Patientenbewegung
Die Patientenbewegung, die u.a. durch die Atembewegung des Patienten verursacht wird, führt zu einem Verschmieren der Bildinformation von bis zu 50 mm.
Die Zahlenwerte der genannten Unschärfen addieren sich nicht einfach, sie müssen nach den Regeln der Fehler-Fortpflanzung überlagert werden. Unter Außerachtlassung der Patientenbewegung ist letztlich eine Systemauflösung zwischen 4 und 6 Millimetern erreichbar.
Sensitivität
Sensitivität ist allgemein formuliert die Gesamtzahl richtig positive Ereignisse im Verhältnis zur Summe der richtig positiven und falsch negativen Ereignisse. Die Sensitivität eines PET-Scanners ist seine wichtigste Geräteeigenschaft, da sie über Bildqualität und Aufnahmedauer entscheidet[32]. In der PET ist die Sensitivität die Zahl an Impulsen pro Sekunde (Trues), die pro Becquerel und Milliliter gemessen werden. Sie wird meist in
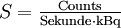 angegeben. Bei der Messung der Aktivität einer injizierten Probe wird ein Bohrlochmessplatz verwendet, von dem man annimmt, dass er alle Szintillationen nachweisen kann. Für die Rekonstruktion eines Bildes guter Qualität ist eine gute Zählratenstatistik Grundvoraussetzung; sie kann nur erzielt werden, wenn das PET aus der injizierten Dosis möglichst viele Trues ermitteln kann. Gute Systeme erreichen Werte von 7 bis 9
angegeben. Bei der Messung der Aktivität einer injizierten Probe wird ein Bohrlochmessplatz verwendet, von dem man annimmt, dass er alle Szintillationen nachweisen kann. Für die Rekonstruktion eines Bildes guter Qualität ist eine gute Zählratenstatistik Grundvoraussetzung; sie kann nur erzielt werden, wenn das PET aus der injizierten Dosis möglichst viele Trues ermitteln kann. Gute Systeme erreichen Werte von 7 bis 9 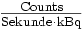 . Beim PET hängt die Sensitivität des Systems von der Photofraktion und dem linearen Schwächungskoeffizienten des Detektormaterials, von der Detektorgeometrie und der Kristalldicke ab. Die Sensitivität eines Systems kann durch Vergrößerung des axialen FOV (Erweiterung um einen zusätzlichen Detektorring) deutlich verbessert werden. Da hierdurch jedoch Koinzidenzen zusätzlich erfasst werden, die das Untersuchungsvolumen schräg durchlaufen, steigt die Wahrscheinlichkeit an, dass diese Photonen gestreut werden, womit ein Verlust an Bildkontrast von Regionen niedriger Anreicherung verbunden ist[33].
. Beim PET hängt die Sensitivität des Systems von der Photofraktion und dem linearen Schwächungskoeffizienten des Detektormaterials, von der Detektorgeometrie und der Kristalldicke ab. Die Sensitivität eines Systems kann durch Vergrößerung des axialen FOV (Erweiterung um einen zusätzlichen Detektorring) deutlich verbessert werden. Da hierdurch jedoch Koinzidenzen zusätzlich erfasst werden, die das Untersuchungsvolumen schräg durchlaufen, steigt die Wahrscheinlichkeit an, dass diese Photonen gestreut werden, womit ein Verlust an Bildkontrast von Regionen niedriger Anreicherung verbunden ist[33].Scatterfraction (=Streustrahlenanteil)
Dies ist der Anteil an gestreuten und zufälligen Koinzidenzen an der Gesamtzahl gemessener Koinzidenzen. Je niedriger die Scatterfraction, desto besser der Bildkontrast. Die Scatterfraction kann verringert werden durch:
- kleines Koinzidenzzeitfenster
- gute Energieauflösung des Detektors und damit gute Ausblendung gestreuter Koinzidenzen
- Abschirmung von Streustrahlung durch Septen und Endshields (Stirnseitig am Detektor angebrachte Blenden).
Die Dicke des durchstrahlten Volumens bestimmt wesentlich den Anteil an Streustrahlung. Aufnahmen dickleibiger Patienten sind daher verrauschter als Scans schlanker Personen.
Noise Equivalent Countrate, NECR
Misst man am PET in einer Versuchsreihe sehr wenig Aktivität und steigert diese langsam, so ergibt sich folgendes Bild:
Die Zahl der gemessenen wahren Koinzidenzen steigt zunächst mit der Dosis an. Zufallskoinzidenzen nehmen jedoch mit zunehmender Aktivität nichtlinear zu, irgendwann sogar stärker als die Zahl der wahren Koinzidenzen (Trues), da die Wahrscheinlichkeit, dass zwei zufällige Ereignisse innerhalb des Koinzidenzzeitfensters auftreten, steigt.
Darüber hinaus machen sich dann auch Totzeiteffekte[18] bemerkbar, da Kristall und Elektronik eine feste Zeitspanne benötigen, um eine Szintillation zu erfassen. Wenn in dieser Zeitspanne bereits das nächste Ereignis stattfindet, kann es nicht erfasst werden und wird verworfen.
Für die Bildqualität bedeutet dies: Bei sehr kleiner zu messender Aktivität ist das Bild stark verrauscht, da die Zahl der gemessenen Ereignisse gering ist. Sie verbessert sich mit zunehmender Aktivität, erreicht jedoch irgendwann ein Maximum. Ein weiterer Dosisanstieg führt zu starkem Verlust an Bildkontrast, das Bild wird wieder flauer.[18]
Die NECR (= Noise Equivalent Count Rate) beschreibt diese Eigenschaft eines PET[18]:
 mit
mitT = Rate der wahren Koinzidenzen
S = Rate der gestreuten Koinzidenzen
R = Rate der Zufallskoinzidenzen
f = Flächenanteil des projizierten Objektes auf die ProjektionsflächeVergangene und künftige Entwicklungen
Die Erfindung der PET wird gemeinhin den amerikanischen Physikern Michel Ter-Pogossian und Michael E. Phelps zugesprochen, die ihre Ergebnisse 1975 publizierten.[34][35] Die erste bildgebende Aufnahme von Positronen wurde jedoch bereits 1950 durchgeführt,[36] und eine computergestützte Bildrekonstruktion auf Basis einer schwächungskorrigierten, gefilterten Rückprojektion existiert bereits seit 1972.[37]
Vom PET zum PET/CT
PET ist bei der richtigen Fragestellung ein hochsensitives Verfahren; Aktivitätsanreicherungen lassen sich jedoch anatomisch nicht immer gut lokalisieren, da in PET Bildern in erster Linie Stoffwechselprozesse aufgezeigt werden; hinzu kommt die begrenzte Ortsauflösung von etwa 4–6 mm. Ein PET/CT kombiniert die hohe Ortsauflösung (von bis zu 0,35 mm) und detailreiche Anatomiedarstellung des CT mit den hochsensitiven Stoffwechselinformationen aus der PET.
Seit dem Jahre 2001 sind daher Geräte auf dem Markt, die einen PET-Scanner mit einem Computertomografen (CT) kombinieren. Das weltweit erste Gerät dieser Art wurde von der Firma General Electric an der Universität Zürich im Jahr 2001 installiert,[38] das deutschlandweit erste Gerät wurde von der Firma Siemens im Jahre 2002 an der Universitätsklinik Essen in Betrieb genommen.
Bei PET/CT-Systemen werden die für die Schwächungskorrektur der PET-Daten nötigen Korrekturmaps aus den Hounsfield-Werten der CT-Daten errechnet. Bei reinen PET-Scannern war hierfür eine eigene Strahlenquelle nötig, mit deren Hilfe diese Schwächungsmap erstellt wurde. Da die Aufnahme des CT-Scans erheblich schneller erfolgt als die früher nötige Transmissionsaufnahme mit Strahlenquelle, ergibt sich daraus eine deutliche Verkürzung der Aufnahmedauer von bis zu 40 %. Die Untersuchungszeit heutiger Geräte liegt im Bereich von 15 bis 30 Minuten.
PET/CT Geräte für den klinischen Einsatz haben reine PET-Scanner mittlerweile (2007) vollständig auf dem Markt verdrängt.
Da noch viele ältere reine PET Scanner im Einsatz sind (s. u.), wird auch oft mittels moderner Software eine Überlagerung (so genannte Soft-Fusion bzw. Koregistrierung) von CT-Bildern und PET-Daten berechnet. Dies geschieht mit Hilfe gemeinsamer Referenzpunkte wie etwa Knochenstrukturen oder anhand externer Positionsdaten. Nachteil der nachträglichen Fusion der Bilddaten ist, dass das für die Bildfusion verwendete CT-Bild nicht zur Rekonstruktion der PET-Daten (eines reinen PET-Scanners) herangezogen wurde, die Bildqualität des resultierendenPET/CT-Bildes daher signifikant schlechter als die eines dedizierten PET/CTs ist. Eine Bildfusion ist auch mit MRT-Bildern möglich, was u.a. in der Strahlentherapie genutzt wird.
Laufende Entwicklung: Hybridgerät aus PET und MRT
Für die nahe Zukunft ist auch eine Gerätekombination von PET und MRT geplant. Ein solches Hybridgerät aus PET und MRT mit einer Feldstärke von 3 Tesla wird im Forschungszentrum Jülich aufgebaut. Dort wurde 2009 ein Hybridgerät mit einer Feldstärke von 9,4 Tesla in Betrieb genommen.[39] An der Universität Tübingen ist seit Mitte 2007 ein PET/MRT Hybridgerät im Einsatz, das für die Hirndiagnostik verwendet wird.[40]
Die Kombination der Modalitäten MRT und PET erfordert, dass sich PET-Bildgebung und MRT-Bildgebung nicht gegenseitig stören. Die normalerweise in PET-Scannern eingesetzten Photomultiplier können aufgrund des für die MR-Bildgebung nötigen Magnetfelds nicht verwendet werden; für die Detektion der PET-Szintillation werden daher Avalanche Photodioden eingesetzt.[41] Die CT-Bilddaten eines PET/CT sind u.a. die Grundlage für die Streustrahlungs- und Absorptionskorrektur. Hounsfield-Einheiten sind letztlich Schwächungseinheiten, die über Lookup-Tabellen den Schwächungskoeffizienten der 511keV Photonenenergie zugeordnet werden können. Herausforderungen bei der Konstruktion eines PET/MR Gerätes bestehen daher u.a. auch darin, diese Information aus einem MR-Bild abzuleiten und die PET-Strahlung ohne Leistungseinbußen des Gesamtsystems abzuschirmen.[42]
Die Kombination der Modalität CT mit der Modalität PET führte dazu, dass sich die Gesamt-Aufnahmezeit drastisch verkürzte, die Bildqualität der PET-Aufnahme erheblich verbesserte und die Überlagerung der beiden Bilder im klinischen PET-Hauptanwendungsgebiet - der Onkologie - einen signifikanten diagnostischen Mehrwert bedeutete;
Die Akquisition von MRT-Bilddaten verlangen eine erheblich längere Akquisitionsdauer als Computertomographien. Ganzkörperaufnahmen, die mit dem PET/CT zur Routine gehören, sind u.a. aus diesem Grund mit einem PET-MRT Gerät wenig praktikabel; daher werden die klinischen Hauptanwendungsfelder wahrscheinlich im Bereich der Neurologie oder der Differenzialdiagnostik ausgewählter Läsionen liegen; zur Kontrolle eines onkologischen Therapieverlaufs oder der Metastasensuche wird ein PET/MR Gerät daher wahrscheinlich weniger geeignet sein, als ein PET/CT-Gerät.
Forschungsthemen
Trotz der langen Historie der PET, wird weltweit an der Verbesserung des Verfahrens gearbeitet. Hier sollen kurz einige aktuelle Forschungspunkte aufgelistet werden:
- Durch die verhältnismäßig langen Aufnahmezeiten, die selbst bei modernen Geräten bei 15 bis 30 Minuten liegen, lässt sich die Bewegung der Patienten im Scanner nicht verhindern. Im Bereich des Abdomens findet auf Grund von Atmung und Herzschlag praktisch immer Bewegung statt. Wegen der stetig steigenden Ortsauflösung neuer Positronen-Emissions-Tomographen wird dieses Problem aber immer auffälliger, denn die Bilder sehen stellenweise verwackelt aus. Es gibt daher weltweit immer mehr Forschungsgruppen die sich diesem Thema widmen und versuchen, mit Hilfe von Bewegungserfassungssystemen (sog. Motion-Tracking) die Bewegung des Patienten während der Untersuchung aufzuzeichnen und um dann ggf. bei starken Bewegungen die Rohdaten einer Aufnahme so zu modifizieren, dass quasi bewegungsfreie Schnittbilder erzeugt werden können.[43][44][45]. Es gibt einige Verfahren, die gänzlich ohne Bewegungserfassungssysteme auskommen. [46][47]
- Experimentelle Entwicklungen zur Steigerung der Ortsauflösung von PET sind – bisher nur anwendbar für kleine Tiergehirne (Ratten) – bis zur praktischen Anwendung fortgeschritten; hier ist die internationale Zusammenarbeit von Forschungsinstituten mit Namen CRYSTAL CLEAR zu nennen, die eine neue Generation von Scannern entwickelt haben. Ortsauflösungen von ca. < 1,6 mm sind erreichbar.[48][49][50]
Potential der Technologie
Im Februar 2007 wurde Dario Crosetto ein Patent für eine Technik zugesprochen, die die Sensitivität eines PET-Scanners um den Faktor 100 verbessert. Bei der Diskussion um Geräteperformance wird das Thema Kristallmaterial allzu oft "gehypt". In diesem Zusammenhang ist es interessant zu lesen, dass der Inhaber des Patents darin beschreibt, dass diese Leistung mit jedem auf dem Markt befindlichen Szintillationsmaterial erbracht werden kann. Das Design beruht auf einer völlig neuen Detektor-Elektronik, die so effektiv arbeitet, dass quasi jede Szintillation gemessen wird. Im Kapitel Sensitivität wurde beschrieben, dass die besten PET-Geräte heute Sensitivitätswerte von knapp 10 Counts pro Sekunde und Kilobecquerel erreichen. Dies bedeutet, dass von 1000 real stattfindenden Annihilationen lediglich 10 detektiert werden, was einer Ausbeute von 1% entspricht. Es ist zu erwarten, dass künftig auch in konventionellen Geräten schnellere Echtzeit-Signalverarbeitung, wie in Crosettos Patent beschrieben, zum Einsatz kommen wird und dies die Sensitivität und den Signal-Rauschabstand der Geräte weiter steigern wird, was den Einsatz von schwach anreichernden Tracern erlaubt.[51][52]
Forschungseinrichtungen
Im deutschsprachigen Raum befasst man sich u. a. in folgenden Forschungseinrichtungen mit der Weiterentwicklung und den Grenzen der PET:
- Forschungszentrum Dresden-Rossendorf
- Universitätsklinikum Essen
- Deutsches Krebsforschungszentrum Heidelberg
- Forschungszentrum Jülich
- Johannes Gutenberg-Universität Mainz, Klinik für Nuklearmedizin, Institut für Kernchemie
- Technische Universität München, Nuklearmedizin
- Westfälische Wilhelms-Universität Münster, Nuklearmedizin
- RheinAhrCampus Remagen, Fachbereich Mathematik und Technik
- Universitätsklinikum Ulm, Klinik für Nuklearmedizin
- Universitätsklinikum Tübingen
Ähnliche Verfahren
Literatur
- O. Schober und W. Heindel: PET-CT Georg Thieme Verlag, 2007, ISBN 3-13-143221-7
- J. Ruhlmann u. a.: PET in der Onkologie: Grundlagen und klinische Anwendung Springer, 1998, ISBN 3-540-64632-9
- K. Wienhard u. a.: PET: Grundlagen und Anwendungen der Positronen-emissions-tomographie Springer, 1989, ISBN 0-387-19451-7
- E. E. Kim u. a. (Herausgeber): Clinical Pet: Principles and Applications Springer 2004, ISBN 0-387-40854-1
Weblinks
- Krebsinformationsdienst des Deutschen Krebsforschungszentrums DKFZ – PET- Positronenemissionstomographie: Ein Blick in den Stoffwechsel
- PET - modernes Diagnose-Verfahren im Kampf gegen Krebs Deutsche Gesellschaft für Nuklearmedizin e.V. und Berufsverband Deutscher Nuklearmediziner e.V. (PDF-Download)
- Möglichkeiten und Grenzen der PET-Tumor-Diagnostik
- PET-Standort in der Nähe finden – Deutsche Gesellschaft für Nuklearmedizin
- Nuclear Medicine Information – PET Themensammlung (englisch)
Quellen
- ↑ a b Frau Dr. rer. biol. hum. Lilli Geworski: Voraussetzungen für die Quantifizierung in der Emissions-Tomographie, Habilitationsschrift zur Erlangung der Lehrbefähigung für das Fach Experimentelle Nuklearmedizin Online
- ↑ Herzog, H.: „Methods and applications of positron-based medical imaging“. Radiation Physics and Chemistry 76, 337-342, 2006.
- ↑ Homepage der Klinik für Nuklearmedizin der Universität Ulm
- ↑ Artikel in www.medscape.com
- ↑ DKFZ: Gallium-68 Peptiddiagnostika
- ↑ Website der Deutschen Gesellschaft für Nuklearmedizin: Konsensuspapiere. abgerufen am 9. Juli 2008
- ↑ Fachinformationen auf der Homepage des PET Zentrums des Universitätsklinikums Ulm
- ↑ PET-CT Zentrum Linz
- ↑ a b c P. D. Shreve u. a.: Pitfalls in Oncologic Diagnosis with FDG PET Imaging: Physiologic and Benign Variants. In: Radiographics 19/1999, S. 61-77. PMID 9925392
- ↑ Usefulness and limits of the SUV for tumor characterisation and patient monitoring in FDG/PET
- ↑ Strahlenschutzkomission (PDF 850 kB)
- ↑ onkodin.de
- ↑ Homepage der Klinik für Nuklearmedizin der Universität Ulm
- ↑ a b Die Positronen-Emissions-Tomografie (PET) Diagnoseklinik München, S. 7.
- ↑ C. Plathow u. a.: Kostenüberlegungen zur Ganzkörper-MRT und PET-CT im Rahmen des onkologischen Stagings. In: Der Radiologe 48/2008, S. 384–396. PMID 17891370
- ↑ Gemeinsamer Bundesausschuß: Richtlinie Methoden vertragsärztliche Versorgung (PET beim kleinzelligen Lungenkarzinom) Online
- ↑ Charles L. Melcher, Scintillation Crystals for PET, J Nucl Med 2000; 41:1051-1055
- ↑ a b c d e R. Standke: Technische Grundlagen der 18F-Fluorodeoxyglukose-Positronen-emissionstomographie-Diagnostik; Acta Medica Austriaca, Blackwell Verlag, 29. Jahrgang, Heft 5 2002, S. 149-155
- ↑ a b Werling, Alexander, Modellbasierte Korrektur der Streustrahlung in der Positronen-Emissions-Tomographie
- ↑ Forschungszentrum Dresden-Rossendorf: Korrektur bewegungsbedingter Artefakte bei Ganzkörperuntersuchungen
- ↑ A. Martínez-Möller, W. Howe, M. Schwaiger, S. Nekolla Motion Free Images by Dual Gating of PET Listmode Acquisitions World Congress of Cardiology, held in Barcelona, Spain, September 2006
- ↑ 4-D PET/CT Keeps Clinicians on Track, Artikel auf http://new.reillycomm.com
- ↑ Discovery 600 Produktinfos auf www.gehealthcare.com
- ↑ PET Evens the Score in PET/CT, Imaging Technology News, July / August 2007
- ↑ Gemini TF auf der Homepage von Philips Medizin Systeme
- ↑ a b Performance of Philips Gemini TF PET/CT Scanner with Special Consideration for Its Time-of-Flight Imaging Capabilities
- ↑ Artikel von Michael Haas auf Imaging Technology News
- ↑ Artikel von S. Surti et al auf ieee.org
- ↑ Homepage von Siemens Medical
- ↑ Panin et al. (Siemens) “Fully 3-D PET Reconstruction With System Matrix Derived From Point Source Measurements”, IEEE Medical Imaging, Vol. 25, No. 7, July 2006.
- ↑ Sánchez-Crespo, et al. “Positron flight in human tissues and its influence on PET image spatial resolution”, Eur J Nucl Med, Vol 31, Iss 1, Jan 2004, pp 44-51.
- ↑ European Journal of Nuclear Medicine, Vol 30, No. 11, November 2003
- ↑ A Comparison of the Imaging Properties of a 3- and 4-ring Biograph PET Scanner Using a Novel Extended NEMA Phantom, C. Jonsson, Member, IEEE, R. Odh, P-O. Schnell and S.A. Larsson, Member, IEEE, 2007 IEEE Nuclear Science Symposium Conference Record,M13-25
- ↑ M.M. Ter-Pogossian, M.E. Phelps, E.J. Hoffman: A positron-emission transaxial tomograph for nuclear imaging (PETT). In: Radiology, v. 114, no. 1, pp. 89-98. 1975
- ↑ M.E. Phelps, E.J. Hoffman, N.A. Mullani, M.M. Ter-Pogossian: Application of annihilation coincidence detection to transaxial reconstruction tomography. In: Journal of Nuclear Medicine 16(3):210-24. 1975
- ↑ Gordon L. Brownell: A history of positron imaging
- ↑ PC-I The First Tomographic Imaging Device and the First Computed Tomographic Imaging Device (PET): 1968-1971
- ↑ Gebert Rüf Stiftung
- ↑ Forschungszentrum Jülich: Hybridgeräte aus MRT und PET im Forschungszentrum Jülich
- ↑ Informationsdienst der Wissenschaft Online
- ↑ Artikel auf radiologytoday.net
- ↑ MRI Based Attenuation Correction for Brain PET Images, Advances in Medical Engineering
- ↑ Forschungszentrum Dresden-Rossendorf: Korrektur von Kopfbewegungen in der PET
- ↑ Motion-free PET: Compensating for patient respiration in whole-body PET/CT imaging
- ↑ Anatomy based PET image reconstruction for a motion influenced volume Feng Qiao, Tinsu Pan, John Clark and Osama Mawlawi; Rice University, Houston, Texas; MD Anderson Cancer Center, Houston, Texas
- ↑ Postacquisition Detecion of Tumor Motion in the Lung and Upper Abdomen Using List-Mode PET Data Bundschuh RA et al., JNM 2007
- ↑ Brinks R, Busch M Local Compensation for Respiratory Motion in List-mode PET in Buzug Th et al Advances in Medical Engineering, Springer Proceedings in Physics, 2007
- ↑ CERN Courier, vol.45, Nr. 6, July/August 2005, p. 27, 28
- ↑ The Crystal Clear Collaboration, von "High Energy Physics" zu "Medical Imaging"
- ↑ GATE - Geant4 Application for Emission Tomography
- ↑ US Patent Nr. 7.180.074
- ↑ ieeexplore.ieee.org: The 3D complete body screening (3D-CBS) features and implementation
Wikimedia Foundation.