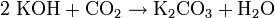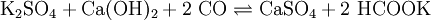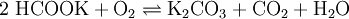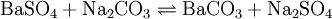- Potasche
-
Strukturformel 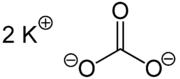
Allgemeines Name Kaliumcarbonat Andere Namen - Pottasche
- kohlensaures Kalium
- E 501
Summenformel K2CO3 CAS-Nummer 584-08-7 Kurzbeschreibung weißes, kristallines Pulver Eigenschaften Molare Masse 138,20 g·mol−1 Aggregatzustand fest
Dichte 2,428 g·cm−3[1]
Schmelzpunkt Siedepunkt Zersetzung
Löslichkeit sehr gut in Wasser (1120 g/l[1]), unlöslich in Alkohol
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 22-26 LD50 1870mg·kg−1 (Ratte, oral) [2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumcarbonat (Pottasche), K2CO3, das Kaliumsalz der Kohlensäure bildet ein weißes, hygroskopisches Pulver mit einer Schmelztemperatur von 891 °C und einer Dichte von 2,428 g·cm−3. Der Name Pottasche stammt von der alten Methode der Anreicherung von Kaliumcarbonat aus Holzasche mittels Lösung der Salze durch Auswaschen mit Wasser und anschließendem Eindampfen in Töpfen (Pötten). Der traditionelle Name stand auch Pate für den englischen Namen von Kalium: potassium.
Inhaltsverzeichnis
Verhalten
In Wasser ist es sehr leicht und gut löslich (1120 g/l). Durch Hydrolyse reagiert die Lösung wegen der Bildung von Kaliumhydroxid alkalisch:
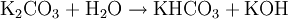 .
.- Kaliumcarbonat reagiert mit Wasser zu Kaliumhydrogencarbonat und Kaliumhydroxid.
Mit Säuren entstehen unter Kohlendioxidentwicklung die entsprechenden Kaliumsalze. Bei Raumtemperatur kristallisiert es als Dihydrat aus der wässrigen Lösung.
Vorkommen
- in einigen Binnengewässern (Totes Meer, Wüste Lop Nor)
- in einigen kleineren Lagerstätten
- In Asche
Gewinnung
Kaliumcarbonat lässt sich nicht wie Natriumcarbonat nach dem Ammoniak-Soda-Verfahren gewinnen, da das Zwischenprodukt Kaliumhydrogencarbonat (KHCO3) zu gut löslich ist.
- Carbonisierung von Kalilauge:
- Als CO2-Quelle nutzt man überwiegend Verbrennungsgase.
- Reaktion von Kalkmilch (Calciumhydroxid-Lösung) mit Kaliumsulfat und Kohlenmonoxid bei 30 bar (Formiatverfahren). Das abgetrennte Kaliumformiat wird anschließend oxidativ calciniert:
- Auslaugen von Pflanzenasche und anschließendes Eindampfen (historisch, technisch keine Bedeutung mehr)
Verwendung
- Herstellung von Schmierseifen
- Düngemittel für saure Böden
- Herstellung von Kaligläsern
- Herstellung von Farben
- Herstellung von fotografischen Entwicklern
- wasserfreies Kaliumcarbonat wird im Laborbereich auch als Trocknungsmittel eingesetzt.
- Triebmittel für Flachgebäck („Plätzchen“, besonders Weihnachtsbäckerei) und Teige mit hohem Zuckergehalt.
- Behandlung von Kakao
- Neutralisationsmittel bei der Verwendung von Salzsäure (E 507) als 'Aromaverstärker'.
- Schnelltrocknung von Rosinen: Durch Entfernen der natürlichen Wachsschicht der Trauben verdunstet die Feuchtigkeit leichter.
- als Ausgangsprodukt für andere Kaliumverbindungen.
- Zum Entfernen von Krusten aus Töpfen: 1 Essl. auf die Kruste im Topf geben, über Nacht stehen lassen und am nächsten Tag mit einer Tasse Wasser aufkochen; die Rückstände lösen sich flockig vom Topfboden.
- Trennmittel für Gipsabgüsse (Bildhauerei)
- Elektrolytbestandteil in Schmelzcarbonatbrennstoffzellen
- Zusatzstoff für die Einnahme von bestimmten Suchtmitteln
- Zusatzstoff in manchen Handwasch-Flüssigseifen
Soda-Pottasche-Aufschluss
Der Soda-Pottasche-Aufschluss wird für schwerlösliche (Erdalkali-)Sulfate, hochgeglühte (saure oder amphotere) Oxide, Silicate und Ag-Halogenide verwendet; der Aufschluss findet in einer Na2CO3/K2CO3-Schmelze statt. ZrO2, Zr3(PO4)4, Al2O3, Cr2O3 und Fe2O3 werden nur teilweise gelöst. Für diesen Schmelzeaufschluss verwendet man Soda und Pottasche im Gemisch, weil damit eine Schmelzpunkterniedrigung gegenüber reinen Salzen zu erhalten ist (Eutektisches Gemisch). Zudem drängt der enorme Carbonatüberschuss das Reaktionsgleichgewicht auf die Produktseite.
Ein Beispiel für Sulfate:
Quellen
- ↑ a b c d Eintrag zu Kaliumcarbonat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24.8.2007 (JavaScript erforderlich)
- ↑ Potassium carbonate bei ChemIDplus
Weblinks
- Artikel Pottasche im Historischen Lexikon der Schweiz
Wikimedia Foundation.