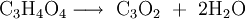- Propadiendion
-
Strukturformel 
Allgemeines Name Kohlenstoffsuboxid Andere Namen - Kohlensuboxid
- Malonsäureanhydrid
- Propadiendion
- Trikohlenstoffdioxid
Summenformel C3O2 CAS-Nummer 504-64-3 PubChem 136332 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 68,03 g·mol−1[1] Aggregatzustand gasförmig
Dichte 3,0 kg·m–3[1]
Schmelzpunkt Siedepunkt 6,8 °C[1]
Löslichkeit reagiert sofort mit Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20-36 S: 23 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kohlenstoffsuboxid, auch Kohlensuboxid oder Malonsäureanhydrid genannt, ist neben Kohlenstoffmonoxid und Kohlenstoffdioxid ein weiteres Kohlenstoffoxid, also eine Verbindung, die ausschließlich aus Kohlenstoff und Sauerstoff aufgebaut ist. Es handelt sich um eine bei Raumtemperatur gasförmige instabile Verbindung. Das giftige und übelriechende Kohlensuboxid kann zur Gruppe der Ketene gerechnet werden, verfügt aber im Gegensatz zu den meisten anderen Vertretern dieser Gruppe über zwei Carbonyl-Gruppen (C=O).
Inhaltsverzeichnis
Geschichte
Benjamin Collins Brodie Junior entdeckte die Verbindung 1873 beim Einwirken von elektrischem Strom auf Kohlenstoffmonoxid.[3] Der Name Kohlensuboxid geht auf Marcelin Berthelot zurück.
Eigenschaften
Physikalische Eigenschaften
 Die Verbindung ist linear gebaut. Die Bindungsabstände liegen zwischen den Werten, die man für Doppel- und Dreifachbindungen erwartet. Sie betragen 128 pm für die beiden CC-Bindungen und 116 pm für die beiden C–O-Bindungen.[4]
Die Verbindung ist linear gebaut. Die Bindungsabstände liegen zwischen den Werten, die man für Doppel- und Dreifachbindungen erwartet. Sie betragen 128 pm für die beiden CC-Bindungen und 116 pm für die beiden C–O-Bindungen.[4]Chemische Eigenschaften
Die Verbindung reagiert bei Einleitung in Wasser zu Malonsäure. Umgekehrt kann sie durch Wasserentzug aus Malonsäure mit Phosphorpentoxid hergestellt werden:
Bei Raumtemperatur erfolgt spontane Polymerisation von einzelnen Kohlensuboxid-Molekülen zu Makromolekülen. Das sich dabei bildende rote bis schwarze feste Polymerisationsprodukt besitzt eine bandartige Struktur (siehe Weblinks) und ist aus ca. 40 C3O2-Einheiten aufgebaut.
Einzelnachweise
- ↑ a b c d webelements.com (Kohlenstoffsuboxid (engl.)
- ↑ Sicherheitsdatenblatt (Merck) (Malonsäure); mangels besserer Quellen ist hier die Gefahrstoffkennzeichnung von Malonsäure angegeben, sinngemäß für das Einatmen abgewandelt, die auch für Kohlenstoffsuboxid gelten, da dies bei Kontakt mit Wasser sofort zu Malonsäure reagiert
- ↑ Brodie B. C. (1873): Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide. Proceedings of the Royal Society (London) 21: 245–247
- ↑ Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 901
Weblinks
Wikimedia Foundation.