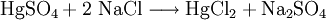- Quecksilbersublimat
-
Strukturformel 
Allgemeines Name Quecksilber(II)-chlorid Andere Namen - Sublimat
- Hydrargyri dichloridum
- Alembrotsalz[1]
Summenformel HgCl2 CAS-Nummer 7487-94-7 Kurzbeschreibung farblose geruchlose Kristalle Eigenschaften Molare Masse 271,5 g·mol–1 Aggregatzustand fest
Dichte 5,44 g·cm–3[2]
Schmelzpunkt 280,7 °C[2]
Siedepunkt 302 °C (Sublimation)[2]
Dampfdruck 0,01 Pa[2] (20 °C)
Löslichkeit mäßig in Wasser (74 g/l, bei 20 °C)[2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 28-34-48/24/25-62-68-50/53 S: (1/2)-26-36/37/39-45-60-61 MAK 0,1 mg·m−3[2]
LD50 1 mg·kg−1[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Quecksilber(II)-chlorid ist ein weißes, in Wasser mäßig lösliches, sehr giftiges Salz, das bei 281 °C schmilzt. Da es beim Erhitzen leicht sublimiert, bezeichnet man es als Sublimat, so dass die Schmelze bei 302 °C kaum beobachtet werden kann.[4] Bemerkenswert ist, dass die Verbindung in wässriger Lösung nur geringfügig in Ionen dissoziiert vorliegt. In verstärktem Maße gilt das für das Quecksilber(II)-cyanid. Quecksilber(II)-chlorid ist im Vergleich zu anderen Halogeniden wie Quecksilber(II)-iodid, welche in Wasser nur im ppm-Bereich löslich sind, recht gut löslich.
Inhaltsverzeichnis
Herstellung
Quecksilber(II)-chlorid entsteht beim Erhitzen von Quecksilber(II)-sulfat mit Natriumchlorid.
Bei der Reaktion von Quecksilber(I)-chlorid mit Chlor oder von Quecksilber(II)-oxid mit Salzsäure oder auch direkt aus den Elementen Quecksilber und Chlor in beheizten Retorten entsteht Quecksilber(II)-chlorid.
Auch die Reaktion von Salzsäure mit Quecksilber(I)-Verbindungen (z.B. Quecksilber(I)-nitrat) ist möglich
Verwendung
Quecksilber(II)-chlorid wirkt pilztötend, darum wurde es früher zum Beizen von Saatgut und zur Imprägnierung von Holz verwendet (Kyanisierung). Da es außerdem antiseptisch wirkt, wurde es als Desinfektionsmittel bei Wunden verwendet. In starker Verdünnung wurde es sogar als Arzneistoff eingesetzt.[5] Aufgrund seiner fixierenden Wirkung wurde es bis um 1900 als Konservierungsmittel für anatomische Präparate benutzt. Wegen seiner Giftigkeit werden heute jedoch andere Stoffe benutzt.
Quecksilber(II)-chlorid ist Bestandteil von Ätzmitteln für die Stahl- und Kupferätzung, Katalysator in der Synthesechemie (zum Beispiel bei der Herstellung von Vinylchlorid) und wird auch als Depolarisator in Trockenbatterien verwendet.[5]
Einzelnachweise
- ↑ http://www.zeno.org/Meyers-1905/A/Alembrotsalz
- ↑ a b c d e f g Sicherheitsdatenblatt (Merck)
- ↑ Eintrag zu CAS-Nr. 7487-94-7 im European chemical Substances Information System ESIS
- ↑ Holleman, Wiberg: Lehrbuch der anorganischen Chemie, 91.−100. Auflage (1985), de Gruyter, Berlin
- ↑ a b H. Hager, F.v. Bruchhausen, P. Surmann, E. Nürnberg: Hagers Handbuch Der Pharmazeutischen Praxis, S. 472, Springer Verlag, 1999, ISBN 3540526412
Literatur
- Brockhaus ABC Chemie (VEB F. A. Brockhaus Verlag, Leipzig, 1971), S. 1159-1160
- Friedrich Moll: Große Männer der Holzimprägnierungstechnik; Z. angewandte Chemie 43, 830-834 (1930)
Wikimedia Foundation.