- Rechargeable Alkaline Manganese
-
Die Alkali-Mangan-Batterie beziehungsweise Alkali-Mangan-Zelle ist ein galvanisches Element und zählt zu den wichtigsten elektrochemischen Energiespeichern. Aufgrund höherer Kapazität, besserer Belastbarkeit und längerer Lagerfähigkeit hat sie die Zink-Kohle-Batterie aus vielen Anwendungen verdrängt. Die Alkali-Mangan-Batterie ist eine Weiterentwicklung des Leclanché-Elements.
Die Alkali-Mangan-Zelle wäre treffender als Zink-Braunstein-Zelle mit alkalischem Elektrolyt beschrieben, da der elektrochemisch aktive Stoff in der negativen Elektrode Zink und in der positiven Elektrode Braunstein (Mangandioxid) ist. Als Elektrolyt wird eine alkalische Lösung, und zwar konzentrierte Kalilauge (Kaliumhydroxid-Lösung) verwendet.
Die Alkali-Mangan-Zelle wird zu den Primärelementen, das heißt den nicht-wiederaufladbaren Batterien gezählt. Es gibt begrenzt wiederaufladbare Versionen, die so genannten RAM-Zellen (Rechargeable Alkaline Manganese), die zu den Sekundärelementen (Akkumulatoren) gerechnet werden. Diese haben allerdings keine weite Verbreitung gefunden.
Die wichtigsten Bauformen sind zylindrische Rundzellen (beispielsweise LR6 = Alkali-Mangan AA oder Mignon) und Knopfzellen (beispielsweise LR44). Mehrere Einzelzellen können auch zu Batterien kombiniert sein (beispielsweise 6LR61 = Alkali-Mangan-9V-Block aus sechs Zellen). In Deutschland wurden 2004 rund 800 Millionen Alkali-Mangan-Rundzellen und rund 40 Millionen Alkali-Mangan-Knopfzellen in Verkehr gebracht (Quelle: Stiftung Gemeinsames Rücknahmesystem Batterien, Erfolgskontrolle 2004).
Inhaltsverzeichnis
Elektrochemie
Wie bei der Zink-Kohle-Batterie liefert die Oxidation von Zink und die Reduktion von Mangandioxid (Braunstein) die elektrische Energie. Die bei der Oxidation freigesetzten Elektronen wandern unter Leistungsabgabe durch den äußeren Stromkreis mit dem Verbraucher von der Anode (negative Elektrode) zur Kathode (positive Elektrode). Zum Ladungsausgleich wandern durch den Elektrolyten OH--Ionen von der Kathode zur Anode. Die in der Alkali-Mangan-Zelle ablaufenden Reaktionen sind komplex und werden im Folgenden vereinfacht dargestellt.
Anodenreaktion
Bei der Entladung wird in der Anode metallisches Zink (Zn) oxidiert. Dabei werden zwei Elektronen abgegeben, die Oxidationszahl von Zink wird von ±0 auf +II erhöht. Das Reaktionsprodukt hängt von den Bedingungen ab, unter denen die Oxidation erfolgt. Zu Beginn der Entladung, das heißt bei hoher OH--Konzentration, wird über verschiedene Zwischenstufen das gut im alkalischen Elektrolyten lösliche Tetrahydroxozinkat-Ion (Zn(OH)42-), kurz Zinkat, gebildet.
Wenn der Elektrolyt mit Zinkat übersättigt ist, beginnt Zinkoxid (ZnO) auszufallen.
Bei fortschreitender Entladung, das heißt bei niedrigerer OH--Konzentration, wird dann Zinkhydroxid (Zn(OH)2) gebildet. Aus diesem entsteht unter Abgabe von Wasser langsam wiederum Zinkoxid (ZnO).
Kathodenreaktion
Das als Kathodenmaterial verwendete Mangandioxid ist in der Regel ein Elektrolyt-Braunstein (γ-MnO2) mit hoher elektrochemischer Aktivität. Bei der Entladung wird in der Kathode Mangandioxid (MnO2) zunächst zu Manganoxidhydroxid (MnOOH) reduziert. Diese homogene Festphasenreaktion wird als erste Entladestufe bezeichnet.
Bei der Reaktion wird ein Elektron aufgenommen, die Oxidationszahl des Mangans wird von +IV auf +III erniedrigt und ein Proton (H+) wird in das Kristallgitter des Mangandioxids eingebaut. Diese Reaktion ist ungewöhnlich, da das Produkt α-MnOOH (Groutit) die gleiche Kristallstruktur wie der Ausgangsstoff γ-MnO2 hat.
Unter bestimmten Bedingungen kann bei milden Entladungen in einer langsamen Reaktion Manganoxidhydroxid (MnOOH) noch weiter reduziert werden. Diese Reaktion wird als zweite Entladestufe bezeichnet.
Diese Reaktion ist eine heterogene Reaktion, die eigentliche Reduktion erfolgt in Lösung. Die Mn3+-Ionen gehen als Komplex [Mn(OH)4]- in Lösung und werden zu [Mn(OH)4]2- reduziert. Das eigentliche feste Produkt Mn(OH)2 fällt dann aus der gesättigten [Mn(OH)4]2--Lösung aus.
Gesamtreaktion
Wird nur die erste Entladestufe berücksichtigt, ergibt sich für die Gesamtreaktion in der Alkali-Mangan-Zelle:
Wie aus der Gesamtreaktionsgleichung ersichtlich, wird bei der Entladung Wasser verbraucht, eine verbrauchte Alkali-Mangan-Zelle ist daher „trocken“.
Nebenreaktionen
Zink ist in stark alkalischer Lösung thermodynamisch instabil. Wie aus der elektrochemischen Spannungsreihe ersichtlich wird daher als Nebenreaktion in der Anode Zink (Zn) oxidiert und Wasser (H2O) zu gasförmigem Wasserstoff (H2) reduziert.
Diese als „Gasung“ bezeichnete Reaktion läuft bei der Lagerung von nicht entladenen und teilentladenen Zellen ab. Die Reaktionsgeschwindigkeit ist für hochreines Zink relativ gering. Bereits kleine Mengen von Verunreinigungen (beispielsweise Schwermetalle wie Eisen, Kupfer, Molybdän und Nickel) können die Gasung jedoch drastisch erhöhen.
Aufbau
 Aufbau einer Mignon-Alkali-Mangan-Zelle.
Aufbau einer Mignon-Alkali-Mangan-Zelle.Das Bild rechts zeigt zwei aufgeschnittene Alkali-Mangan-Zellen und den abgetrennten oberen Bereich. Der Plus-Pol ist, anders als bei einer Zink-Kohle-Batterie, Teil des Außenmantels und elektrisch mit ihm verbunden. Im Inneren bildet gepresster Braunstein die Kathode, im Bild als schwarzer Ring innerhalb des Mantels zu erkennen. Die Anode besteht aus einer Paste aus Zink und Kaliumhydroxid, eingewickelt in ionendurchlässiges Faserpapier. In der mittleren Ansicht ragt es über die abgeschnittene Zelle hinaus. Links erkennt man den Metallstift, der den elektrischen Kontakt mit der Bodenplatte herstellt und den Minus-Pol bildet.
 9V-Alkali-Mangan-Blockbatterie im Längsschnitt.
9V-Alkali-Mangan-Blockbatterie im Längsschnitt.Eine 9V-Alkali-Mangan-Blockbatterie enthält 6 Rundzellen der Baugröße Piccolo (AAAA, LR61). Ihre Anordnung innerhalb des Batterie-Gehäuses ist links im Bild zu erkennen. Rechts sieht man drei Zellen im Längsschnitt. Die Kapselung der Einzelzellen erhöht die Auslaufsicherheit, reduziert aber die Packungsdichte und damit die Kapazität. Diese Batterien tragen die Größenbezeichnung 6LR61. Einige, zumeist asiatische Hersteller verwenden auch 6 rechteckige Knopfzellen als Stapel, diese Typen sind mit 6LF22 bezeichnet.
Eigenschaften
Spannung
Die Nennspannung der Alkali-Mangan-Zelle liegt bei 1,5 V. Höhere Spannungen können durch Reihenschaltung mehrerer Einzelzellen erzielt werden, beispielsweise mit drei Zellen bei der Normalbatterie 3LR12 4,5 V, mit vier Zellen beim Flat-Pack 4LR61 6 V und mit sechs Zellen beim E-Block 6LR61 9 V. Die tatsächliche Leerlaufspannung einer nicht entladenen Alkali-Mangan-Zelle liegt meist im Bereich 1,50 bis 1,65 V – sie hängt hauptsächlich von der Aktivität des verwendeten Mangandioxides und dem Zinkoxidgehalt in der Elektrolytlösung ab. Die (mittlere) Lastspannung hängt von der Belastung und dem Entladegrad ab, sie beträgt typischerweise 1,10 bis 1,30 V. Entladeschlussspannungen liegen meist im Bereich 0,8 bis 1,0 V.
Entladung
 Entladekurven einer Alkali-Mangan-Zelle im Vergleich zu Zink-Kohle-Zelle und NiMH-Akku
Entladekurven einer Alkali-Mangan-Zelle im Vergleich zu Zink-Kohle-Zelle und NiMH-AkkuDas Diagramm vergleicht die Belastungskurven bei konstantem Strom einer Zink-Kohle-Zelle (Zn-Mn (C)) und eines NiMH-Akkus mit der einer Alkali-Mangan-Zelle (Zn-Mn (KOH)). Die Spannung der Zink-Kohle-Zelle fällt nach kurzer Zeit unter 0,8 V ab. Ein Akku hält die Spannung von 1,2 V über einen langen Zeitraum. Das Zeitverhalten einer Alkali-Mangan-Zelle liegt zwischen den beiden Kurven, die Spannung nimmt langsam mit der Zeit ab.
Bei einer Steigerung der Belastung erreicht die Alkali-Mangan-Zelle die 0,8 V-Grenze überproportional schnell. Der gestiegene Innenwiderstand verhindert die Bereitstellung der Leistung, obwohl Kapazitätsreserven von 20 % und mehr vorhanden sein können. Nach einer Regenerationszeit von einigen Stunden sinkt der Innenwiderstand und die Batterie kann mit kleiner Leistung weiter arbeiten.
Beispiel: Alkali-Batterien in Hochleistungs-Verbrauchern scheinen nach kurzer Zeit leer zu sein. Nach einer Pause von mehreren Stunden arbeiten sie kurzzeitig wieder. Leicht erhöhte Temperatur beschleunigt diese Regeneration. Daher rührt der Effekt vom „Aufladen“ von Batterien auf der Herdplatte oder an der Sonne. Anschließend sind diese Zellen jedoch nicht mehr in der Lage, den hohen Strombedarf zu decken. Aus Sicht des Hochleistungs-Verbrauchers sind die Batterien erschöpft, obwohl sie noch eine Restkapazität von 30 % besitzen können. Anstatt die Zellen zu entsorgen, sollten sie für Verbraucher mit geringerem Leistungsbedarf genutzt werden, z. B. Uhren oder Fernbedienungen.
Vergleich Alkali-Mangan- und Zink-Kohle-Zelle
Vergleich Baugröße Mignon Alkali-Mangan Zink-Kohle Energiedichte in Wh/l 350 150 Kapazität in Ah (Entladung bis 0,8 V) 2,8 1,2 Innenwiderstand in Ohm 0,15 0,5 Selbstentladung in % pro Monat bei 20 °C 0,2 7 Kapazität bei konst. Selbstentl. nach 3 J. in % 92 10 Kapazität bei konst. Selbstentl. nach 5 J. in % 85 1 Minimale Betriebstemperatur (in °C) < -20 -10 Auslaufsicherheit hoch ausreichend bis schlecht (insb. bei qualitativ minderwertigen Zellen) Linearität der Strom/Zeit-Charakteristik siehe Diagramm siehe Diagramm typ. Kosten pro entnommener Ladung 8–45 Cent/Ah 17–80 Cent/Ah Bemerkung:
Zink-Kohle-Batterien haben ihre Berechtigung vollständig verloren:
- Preis: Zink-Kohle-Batterien sind pro Ah ca. doppelt so teuer wie Alkali-Mangan-Batterien und das in jedem Preissegment (1Ah kostet bei preiswerten Zellen: Alkaline 8 Cts., bei Zink-Kohle 17 Cts.).
- Spannungslage: Zink-Kohle-Batterien haben eine wesentlich schlechtere Spannungslage, d.h. die Spannung teilentladener Zellen fällt sehr zeitig ab.
- Hochstrombelastbarkeit: Zink-Kohle-Batterien können nur begrenzt hohe Ströme abgeben. Weiterhin fällt die ohnehin sehr geringe Leistungsfähigkeit weiter ab.
- Für viele moderne Geräte, die kurzzeitig hohe Ströme entnehmen (Digitalkameras, Blitzgeräte, Alarmanlagen), sind Zink-Kohle-Batterien nicht mehr verwendbar. Die hohe Stromentnahme (1...2 A sind ein Anhaltswert) lassen selbst bei frischen Zink-Kohle-Batterien die Spannung in wenigen Sekunden zu tief fallen.
- Die Auslaufsicherheit ist häufig schlechter. Die ausgelaufene Säure zerstört die Metallkontakte und Leiterbahnen eines elektronischen Gerätes deutlich stärker als der alkalische Elektrolyt der Alkaline-Zellen.
- Die Selbstentladung von Zink-Kohle-Batterien ist um ca. den Faktor 10 bis 20 höher als der von Alkali-Mangan-Zellen.
- Selbst in der Öko-Bilanz stehen die Zink-Kohle-Batterien schlechter da. Geringen Vorteilen steht die drastisch schlechtere Kapazität gegenüber.
Wiederaufladen
Teilentladene Alkali-Mangan-Primärbatterien können unter Umständen mehrfach (5- bis 20-mal) wieder aufgeladen werden. Dazu legt man an eine Zelle eine Konstantspannung von 1,65 V an; der Ladestrom stellt sich entsprechend ein. Ladegeräte für Nickel-Cadmium- (NiCd-) oder Nickel-Metallhydrid- (NiMH-)Akkus sind nicht geeignet.
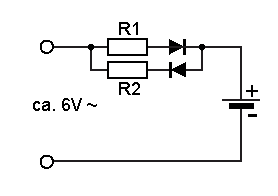
Als besonders effektiv hat sich die Ladung mit asymmetrischem Wechselstrom erwiesen. In nebenstehender Abbildung ist eine einfache Ladeschaltung für Alkali-Mangan-Zelle dargestellt.
Über die obere Diode und R1 wird die Batterie mit der positiven Halbwelle des Wechselstroms geladen, und über die untere Diode und R2 mit der negativen Halbwelle wieder entladen. Dadurch wird kristallinen Ablagerungen an den Elektroden der Batterie entgegengewirkt, wie auch Gasbildungen, die zum Explodieren der Batterie führen könnten. Die folgenden Werte beziehen sich auf 1 Mignon (AA) Alkaline-Batterie.
R1 wird so eingestellt, dass etwa 80 mA über die obere Diode fließen, und R2 so, dass etwa 20 mA über die untere Diode fließen. Im Normalfall ist die Ladung abgeschlossen, wenn die Spannung an der Batterie etwa 1,7 V erreicht hat. Bei diesem Ladestrom dauert der Ladevorgang etwa 24 bis 30 Stunden, je nachdem, wieweit die Batterie vorher entladen war. Vollständig entladene Batterien oder auslaufende Batterien sollten nicht wieder aufgeladen werden. Das Aufladen von normalen Alkali-Mangan-Batterien ist mit dieser Methode angeblich ungefährlich.
- Warnhinweis
- Primärbatterien sind nicht zum Wiederaufladen ausgelegt. Sie können beim Ladevorgang insbesondere undicht werden und auslaufen. Eine Explosion einer Alkali-Mangan-Zelle ist beim Laden mit geringem Strom zwar unwahrscheinlich, bei ungeeigneten Parametern können sie jedoch explodieren (fehlender Berstschutz) oder durch den Druckaufbau wird der Mittelstift ausgetrieben und die Zinkpaste entweicht explosionsartig. Die Batterien beginnen nach mehreren Ladezyklen auszulaufen, daher ist es angebracht, sie nicht im Batteriefach von Elektrogeräten, sondern in separaten, leicht zu reinigenden Batteriehaltern aufzuladen.
Alkali-Mangan-Batterien kann man auch mit kleinen Solarzellen aufladen oder stützen, wenn der Ladestrom wesentlich unter 100 mA liegt. Die Spannung muss unter dem Wert von 1,65 V bleiben, um Gasen und damit Druckaufbau zu vermeiden. Die damit teilgeladenen Batterien kann man für Zwecke mit niedrigem Stromverbrauch wie zum Beispiel für eine Beleuchtung mit Leuchtdioden benutzen.
Die Aufladung wird umso schwieriger, je mehr die Batterie vorher entladen wurde. Vollständig entladene Batterien können daher kaum mehr geladen werden.
RAM-Zellen
Sogenannte RAM-Zellen (rechargeable alkali manganese) sind spezielle, etwa 25-mal wiederaufladbare Alkali-Mangan-Zellen. Kommerzielle Ladegeräte für RAM-Zellen arbeiten mit konstantem Ladestrom, der jede Sekunde für wenige Millisekunden unterbrochen wird, um stromlos die Zellenspannung zu messen. Wenn diese 1,73 V überschreitet, dann wird der Ladestrom so lange abgeschaltet, bis die Zellenspannung 1,69 V wieder unterschritten hat. Die Konstantspannungsmethode ist ebenfalls sicher und geeignet, dafür aber langsamer. RAM-Zellen eignen sich nur für Niedrigstrom-Anwendungen, wie z. B. in Uhren oder Fernbedienungen. Für Hochstrom-Anwendungen, wie z. B. in Digitalkameras, Akku-Werkzeugen oder Modellfahrzeugen, sind sie nicht geeignet und können dabei beschädigt werden. Des Weiteren dürfen RAM-Zellen nicht komplett entladen werden, da sie dadurch Schaden erleiden (verkürzte Lebensdauer). Eine Benutzung in einem Gerät, bis dessen Batteriezustandsanzeige eine Warnmeldung ausgibt, ist auf jeden Fall zu vermeiden. Die Zellspannung sollte nicht unter 1,2 V sinken. RAM-Zellen sollten nur im geladenen Zustand gelagert werden.
Entsorgung
Alkali-Mangan-Batterien können in Deutschland wie auch andere Batterien zurück in Batterien verkaufende Einzelhandelsgeschäfte gebracht werden, die zu diesem Zweck Sammelbehälter aufgestellt haben.
Batterien und Akkumulatoren gehören nicht in andere Müllsammelbehälter oder in die Umwelt, da sie umweltschädliche und wiedergewinnbare Stoffe enthalten.
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren - Mobile Energiequellen für heute und morgen. Springer, Berlin 1998 ISBN 3-540-62997-1
- David Linden, Thomas B. Reddy (Hrsg.): Handbook of Batteries. 3. Auflage. McGraw-Hill, New York 2002 ISBN 0-071-35978-8 (auf Englisch)
- Clive D.S. Tuck (Hrsg.): Modern Battery Technology. Ellis Horwood, New York 1991 ISBN 0-13-590266-5 (auf Englisch)
- Karl V. Kordesch (Hrsg.): Batteries Volume 1 Manganese Dioxide. Marcel Dekker, New York 1974 ISBN 0-8247-6084-0 (auf Englisch)
- Andreas Jossen, Wolfgang Weydanz: Moderne Akkumulatoren richtig einsetzen, Printyourbook 2006, ISBN 9783939359111
Weblinks
- Datenblätter einiger Batterien der Fa. Energizer (auf Englisch)
- Vergleich der Leistungsdaten von Batterien und Akkus
- http://www.grs-batterien.de Stiftung Gemeinsames Rücknahmesystem Batterien
Primärzellen: Alkali-Mangan-Batterie | Daniell-Element | Leclanché-Element | Lithium-Batterie | Lithium-Eisensulfid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Titanat-Akkumulator | Vanadium-Redox-Akkumulator
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Konzentrationselement | Redox-Flow-Zelle | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.


![Zn + 4OH^- \rightarrow [Zn(OH)_4]^{2-} + 2e^-](/pictures/dewiki/48/001796d47ff3e6168807efcdf8f61063.png)
![[Zn(OH)_4]^{2-} \rightarrow ZnO + 2OH^- + H_2O](/pictures/dewiki/97/a082352f6fbc4c4a37ea795cf98b4d51.png)
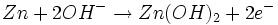
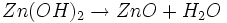

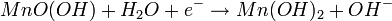
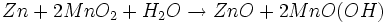
![Zn + 2H_2O + 2OH^- \rightarrow [Zn(OH)_4]^{2-} + H_2](/pictures/dewiki/101/e1e1df7678a2ff5ad7b20f90bcbcb376.png)