- Renal
-
Die Niere (lat. ren, griech. νεφρός, nephros) ist ein paarig angelegtes Organ der Wirbeltiere. Der medizinische Fachbereich, der sich mit den Nieren und ihren Krankheiten beschäftigt, ist die Nephrologie, ein Teilgebiet der inneren Medizin.
Inhaltsverzeichnis
Funktionen der Niere
Eine Funktion der Nieren ist die Ausscheidung von Endprodukten des Stoffwechsels, den sogenannten harnpflichtigen Substanzen, und Giftstoffen aus dem Körper durch Bildung des Harns, welcher schließlich über die Harnwege aus dem Körper ausgeschieden wird. Die Niere bilanziert den Wasserhaushalt und dient damit der langfristigen Blutdruckeinstellung, reguliert durch die Kontrolle der Zusammensetzung des Harns den Elektrolythaushalt und den Säure-Basen-Haushalt. Weiterhin ist die Niere ein bedeutendes Organ für den Zwischenstoffwechsel des Körpers (sie betreibt Gluconeogenese). Die Niere produziert Hormone, wie beispielsweise Erythropoetin, für die Blutbildung und ist der Abbauort von Peptidhormonen, aber auch viele Funktionen der Niere selbst werden durch Hormone gesteuert.
Die funktionelle Grundeinheit der Niere ist das Nephron, das aus Nierenkörperchen und Nierenkanälchen besteht. Die prinzipielle Funktionsweise eines Nephrons lässt sich grob in zwei Schritte unterteilen: Im ersten Schritt, welcher im Nierenkörperchen stattfindet, wird aus dem Blut durch Filtration der Primärharn abgepresst, der in seiner Zusammensetzung ungefähr dem Blutplasma entspricht. Bei dieser Filtration werden Bestandteile über einer bestimmten Größe, darunter die Blutkörperchen und größere Moleküle, zurückgehalten. Im sogenannten Primärharn sind nun alle niedermolekularen Bestandteile des Blutplasmas enthalten, darunter solche, die ausgeschieden werden sollen, und auch solche, die für den Körper wertvoll sind und nun kontrolliert in den Blutkreislauf zurückgeholt (resorbiert) werden, wie Zucker, Aminosäuren und Elektrolyte. Weiterhin wird ein Großteil des abgefilterten Wassers rückresorbiert, welches dem Körper nicht verloren gehen darf. Diese Vorgänge geschehen im sich dem Nierenkörperchen anschließenden, schlauchartigen Tubulussystem und konzentrieren den Primärharn zum Endharn, welcher sich im Nierenbecken, welches bereits Teil der Harnwege ist, sammelt und über den Harnleiter zur Harnblase geleitet wird.
Makroskopische Anatomie
Beim Menschen
Lage und Nachbarschaftsbeziehungen
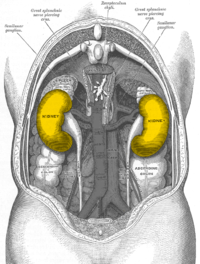
Beim Menschen liegen die Nieren retroperitoneal (hinter dem Bauchfell), beiderseits der Wirbelsäule, welche sie nach vorn nicht überragen, unterhalb des Zwerchfells, in der Fossa lumbalis. Die Nieren liegen etwa in Höhe des zwölften Brustwirbels bis dritten Lendenwirbels, die rechte ungefähr eine halbe Wirbelhöhe tiefer (wegen des wesentlich größeren rechten Leberlappens). Die oberen Nierenpole (siehe unter Form) sind etwa 7 cm voneinander entfernt, die unteren etwa 11 cm. Die Längsachsen beider Organe zeigen folglich nach oben in Richtung Körpermitte. Die unteren Nierenpole sind beim Mann rechts 3 cm, links 4 cm, bei der Frau 2,5 cm bzw. 3 cm vom Beckenkamm entfernt, können aber variabel auch den Beckenkamm erreichen. Die Lage der Nieren ist atemabhängig. Sie bewegen sich bei der Einatmung wie auch das Zwerchfell nach caudal. Beim Neugeborenen ist die Niere immer vergleichsweise größer als andere Strukturen und überragt daher regelhaft den Beckenkamm.
Die Nieren haben – außer unmittelbar zu den Nebennieren – getrennt durch die Fettkapsel Kontaktflächen zu mehreren Organen des Bauchraums. Die Kontaktflächen unterscheiden sich bei linker und rechter Niere: Die linke Niere wird von Magen, Milz, den Milzgefäßen (A. und V. splenica), Bauchspeicheldrüsenschwanz (Cauda pancreatis) und Grimmdarm (Colon descendens) überlagert. Sie bildet mit einer dreieckigen Fläche, die Kontakt zum Bauchfell hat, einen Teil der Rückfläche der Bursa omentalis. Die rechte Niere wird vor allem von der Leber, aber auch von Grimmdarm und Duodenum (Pars descendens duodeni), überlagert. Wegen des Platzbedarfs des rechten Leberlappens der im Körper rechts gelegenen Leber (mit der Impressio renalis) ist die rechte Niere tiefer gelegen als die linke. Auf beiden Nieren sitzt häubchenartig die halbmondförmige Nebenniere.
Die Nerven Nervus subcostalis, Nervus iliohypogastricus und Nervus ilioinguinalis überqueren die Rückseite der Nieren. Deshalb sind Schmerzen aus den Nieren in die Innervationsgebiete dieser Nerven, in der Unterbauchgegend möglich.
Form, Farbe und Größe
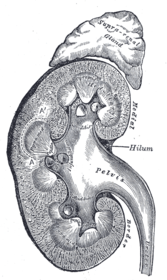
Die Nieren sind bohnenförmig und braunrot. Sie haben eine Länge von 10 bis 12 cm, eine Breite von 5 bis 6,5 cm und eine Dicke von 3 bis 5 cm (Merkwert: 12 cm × 6 cm × 3 cm). Die Masse variiert zwischen 120 und 200 g. Gewöhnlich ist die linke Niere etwas größer und schwerer. Ist eine Niere deutlich verkleinert oder fehlt sie, so ist die andere meist vergrößert. Beim Menschen zeigen die Nieren zwei sogenannte Nierenpole nach oben und unten, zwei Flächen nach vorne und hinten (ventral und dorsal) und zwei Ränder nach medial und lateral. Der nach außen gerichtete Rand ist konvex, der nach medial gerichtete Rand ist konkav und bildet eine Einziehung, in der das Hilum renale, die Ein- und Austrittspforte der Leitungsbahnen, liegt.
Nierenhilus und Leitungsbahnen
Am Nierenhilus verzweigen sich von ventral nach dorsal Vena renalis, Arteria renalis und der Ureter sowie einige Lymphgefäße und Nerven. Der Hilus erweitert sich im Inneren der Niere in den Sinus renalis, der vom Nierenbecken (Harnwege) und Fettgewebe ausgefüllt wird.
Jede Niere wird von meist einer (sehr selten mehreren) direkt aus der Aorta entspringenden Arteria renalis mit Blut versorgt. Die A. renalis zweigt von der Aorta beiderseits in Höhe der Arterie mesenterica superior ab, zeigt abwärts und teilt sich bereits vor dem Hilum in einen vorderen und hinteren Hauptstamm (Ramus anterior et posterior), welche nach ihrer Lage zum Nierenbecken benannt sind und die Segmentarterien abgeben:
Aus dem vorderen Hauptstamm entspringen vor dem Hilus vier Segmentarterien, die A. segmenti superioris, A. segmenti anterioris superioris, A. segmenti anterioris inferioris, A. segmenti inferioris. Der hintere Haupstamm gibt eine A. segmenti posterioris ab und versorgt nur ein Segment an der Rückseite der Niere. Auf die Arteriae segmentorum folgen die Arteriae interlobares, darauf die Arteriae arcuatae, darauf die Arteriae interlobulares (auch Arteriae corticales radiatae), welche schließlich die Vasa afferentia für die Nierenkörperchen der Nephrone abgeben. Zur genaueren Beschreibung der arteriellen Versorgung siehe Feinbau und den Artikel Nephron.
Die Nierenarterie und jeder ihrer Endäste sind Endarterien, es liegen keine Anastomosen vor, sodass der Verschluss eines Astes jeweils zum Absterben des von ihm versorgten Nierengewebes führt (Nekrose, Niereninfarkt).
Die Vena renalis führt das Blut unmittelbar in die Vena cava inferior. Im Körper liegt die Aorta links, die Vena cava inferior rechts, weshalb die linke Vena renalis länger ist als die rechte. Sie liegt vor der Aorta, unter dem Abgang der Arteria mesenterica superior (→ Nussknacker-Syndrom) und nimmt die V. testicularis bzw. ovarica sinistra auf.
Der von der Niere ins Nierenbecken abgegebene Urin wird jeweils durch den Harnleiter, den Ureter, zur Harnblase transportiert.
Lymphkapillarnetze im Inneren der Niere sammeln die Lymphe der Niere und bilden am Hilus wenige Hiluslymphgefäße.
Die sympathischen Nerven der Niere entstammen als postganglionäre Fasern dem Plexus coeliacus und verlaufen mit der Arteria renalis. Sie versorgen neben dem Nierenparenchym die schmerzempfindliche Kapsel. Die parasympathischen Nerven der Niere entstammen als Rami renales direkt dem Nervus vagus (X. Hirnnerv).
Hüllen
Zu den Hüllen der Nieren gehören die Capsula fibrosa, Capsula adiposa und Fascia renalis:
Beide Nieren sind jeweils von einer dünnen, festen und glatten bindegewebigen Organkapsel (Capsula fibrosa) umhüllt. Sie enthält nur sehr wenige elastische Fasern und ist kaum dehnbar.
Zusammen mit den Nebenniere folgt ein lockerer Fettgewebskörper aus Baufett, die Capsula adiposa, welche die Niere einbettet und abpolstert. Die Capsula adiposa ist rückenseitig und seitlich stärker ausgebildet als bauchwärts und setzt sich in das Fett des sinus renalis im Niereninneren fort. Der Fettkörper kann bei starker Unterernährung abgebaut werden.
All dies umhüllt die Fascia renalis, ein Fasziensack, der die Niere, Nebenniere und den Fettkörper nach vorne, seitlich und hinten einfasst, dabei aber nach medial oben und unten unverschlossen ist. Hinter dem Nierenfasciensack liegt das retrorenale Fett (Massa adiposa pararenalis), in welchem Nerven des Plexus lumbalis verlaufen.
Innerer Aufbau: Rinde und Mark
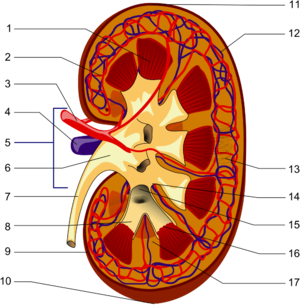 Schema des makroskopischen Aufbaus der Niere:
Schema des makroskopischen Aufbaus der Niere:
1. Nierenmark mit Markkegeln (Pyramides renales)
2. Vas afferens
3. Nierenarterie (Arteria renalis)
4. Nierenvene (Vena renalis)
5. Hilum renale
6. Nierenbecken (Pelvis renalis)
7. Harnleiter (Ureter)
8. kleine Nierenkelche (Calices minores renales)
9. Nierenkapsel (Capsula fibrosa renalis)
10. unterer Nierenpol (Extremitas inferior)
11. oberer Nierenpol (Extremitas superior)
12. Vas efferens
13. Nephron
14. Nierenbucht (Sinus renalis)
15. große Nierenkelche (Calices majores renales)
16. Spitzen der Markkegel (Papillae renales)
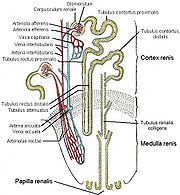
17. Bertini-Säulen (Columna renalis)Das Nierenparenchym, die eigentliche Organmasse der Niere, wird in die außen liegende Nierenrinde (Cortex renalis) und das nach innen zum Hilum gerichtete Nierenmark (Medulla renalis) unterteilt. Das Mark besitzt dabei die Form von Pyramiden (10 bis 12 Markpyramiden oder Nierenpyramiden), die mit ihrer Basis nach außen und mit ihrer Spitze nach innen zum Hilum zeigen. Diese Spitzen, die Papillen, reichen frei in den Hohlraum der Nierenkelche (Calix renalis), die sich in variabler Form zum Nierenbecken (Pelvis renalis) zusammenschließen, aus dem der Ureter hervorgeht. In dieser Anordnung fließt der Urin aus den Papillen in Richtung Ureter.
Die Nierenrinde liegt wie eine Kappe zwischen den Basen der Markpyramiden und der Organkapsel (subkapsulärer Anteil), erreicht aber zwischen den Pyramiden in säulenförmigen Abschnitten (Columnae renales) den Sinus renalis. Der subkapsuläre Anteil der Rinde wird von gut sichtbaren, feinen Strichen durchzogen, den Markstrahlen (Radii medullares), die radiär aus den Markpyramiden in Richtung der Organkapsel ausstrahlen und Teil des Marks sind. Im Mark selbst lassen sich durch ihre leicht unterschiedliche Farbe ein äußeres Mark, bestehend aus einem Außen- und einem Innenstreifen, und ein zum Nierenbecken gelegenes inneres Mark unterscheiden.
Bei anderen Säugetieren
Die prinzipielle Lage ist auch bei den anderen Säugetieren typisch, hier liegen die Nieren (entsprechend der horizontalen Körperorientierung) hinter dem Zwerchfell. Bei den meisten Säugetieren liegt die rechte Niere etwas weiter vorn. Bei Wiederkäuern ist die linke Niere durch die Ausbildung des Pansens nach rechts, hinter die rechte Niere verlagert (physiologische Wanderniere).
Bei den einzelnen Säugetieren ist die Niere unterschiedlich aufgebaut. In der einfachsten Form besteht die Niere aus einzelnen, kegelförmigen Nierenlappen (Lobi renales). Diese mehrlappige Niere ist typisch für Meeressäugetiere und Bären. Jeder Nierenlappen besteht aus einer Rindenkappe und einer Markpyramide, die in einer Nierenpapille (Papilla renalis, das spitze Ende des Kegels) endet.
Bei den meisten Säugetieren verschmelzen diese Nierenlappen (beim Menschen 6 Lappen) in unterschiedlichem Ausmaß. Die verschmelzenden Rindenkappen bilden die Nierenrinde (Cortex renis), die Pyramiden das Nierenmark (Medulla renis).
Bei Rindern verschmelzen nur die Mittelteile der einzelnen Nierenlappen, wodurch an der Oberfläche Furchen entstehen und die Nierenpapillen ebenfalls erhalten bleiben. Diese Bauform nennt man mehrwarzig-gefurchte Niere. Diese Form tritt zwischenzeitlich auch in der fetalen Entwicklung der Niere bei den Säugetieren auf, die durch weitere Verschmelzungsvorgänge gekennzeichnet sind. Auch das menschliche Neugeborene besitzt noch eine mehrwarzig-gefurchte Niere.
Bei Primaten (einschl. Mensch) und Schweinen verschmelzen die Rindenanteile nach der Geburt vollständig, so dass die Organoberfläche glatt erscheint. Die einzelnen Papillen bleiben jedoch erhalten. Man spricht von einer mehrwarzig-glatten Niere.
Bei den meisten Säugetieren verschmelzen nun auch die einzelnen Nierenpapillen zu einer Nierenleiste (Crista renalis), so dass man von einer einwarzig-glatten Niere spricht.
Feinbau
Der Feinbau der Niere zeichnet sich durch ein hochdifferenziertes Tubulussystem und eine spezifisch angepasste Blutversorgung aus. Das Tubulussystem lässt sich aufgrund der Embryonalentwicklung in zwei Teile gliedern, das Nephron im engeren Sinne, und das Sammelrohr. Beide bilden jedoch eine funktionelle Einheit, so dass der Begriff Nephron häufig auch das gesamte Tubulussystem bezeichnet.
Blutversorgung der Niere
Verzweigungen
Die Segmentarterien (siehe oben) teilen sich weiter auf. Eine Arteria interlobaris versorgt je zwei angrenzende Markpyramiden und entsprechende Rindenbereiche. Sie verläuft in den Rindensäulen entlang der Seiten der Pyramiden in Richtung Rinde, verzweigt sich aber an der Basis der Pyramide in Arteriae arcuatae. Diese verlaufen bogenförmig an der Mark-Rinden-Grenze und geben in rechtem Winkel die radiär nach oben durch die Rinde verlaufenden Arteriae corticales radiatae sowie ebenfalls nahezu rechtwinklig in Markrichtung die Arterae rectae ab.
Erstes und zweites Kapillarbett
Aus diesen gehen schließlich die Vasa afferentia hervor, die sich zu je einem Kapillarknäuel, dem Glomerulus (siehe unten), aufteilen. Aus diesem ersten Kapillargebiet läuft das immer noch sauerstoffreiche Blut wieder im Vas efferens zusammen. Von dort tritt das Blut in ein zweites Kapillarbett ein, diesmal zur Versorgung des Nierengewebes. Dabei muss man zwei Fälle je nach Lage des Glomerulus unterscheiden: aus oberflächlichen Glomeruli, die im oberen Bereich der Rinde zur Organkapsel hin liegen, gelangt das Blut in das peritubuläre Kapillarnetz der Rinde, das die dort gelegenen Tubuli umspinnt. Aus juxtamedullären Glomeruli jedoch, die tiefer zur Mark-Rinden-Grenze hin liegen, entspringen die Gefäße zur Versorgung des Marks.
Die Versorgung des Marks
Diese kapillären Gefäße zur Versorgung des Marks sind die Vasa recta, die ganz gerade oft bis zur Papillenspitze absteigen und wieder in umgekehrter Richtung aufsteigen. Es gibt zahlreiche Querverbindungen zwischen ab- und aufsteigendem Schenkel. Die besondere Gefäßarchitektur des Marks ist von großer funktioneller Bedeutung für die Fähigkeit der Niere zur Harnkonzentrierung. Im Rahmen des Gegenstromprinzips erzeugt die Niere zur Papillenspitze hin einen erheblichen osmotischen Gradienten (siehe unten), der ausgewaschen würde, wäre das Mark mit einem normalen Kapillarnetz versorgt. Der Preis dafür ist aber eine sehr schlechte Sauerstoffversorgung des Nierenmarks, da der Sauerstoff aus dem sauerstoffreichen, absteigenden Schenkel der Vasa recta direkt schon oben in den aufsteigenden, sauerstoffarmen Schenkel diffundieren kann.
Venöses System
Beide Kapillarnetze erreichen schließlich das venöse System der Niere, das mit Ausnahme der Glomerula und ihren afferenten und efferenten Arteriolen, dem arteriellen System analog aufgebaut ist.
Nephron
Hauptartikel: Nephron. Dort werden im übrigen auch die Harnkonzentrierungsmechanismen beschrieben.
Die Niere besteht aus zahlreichen Einheiten, den Nephronen, in denen der Harn gebildet wird. Jede der menschlichen Nieren enthält 1 bis 1,4 Mio. Nephrone. Das Nephron selbst besteht aus einem Nierenkörperchen (Corpusculum renis) und einem Tubulusapparat (Tubuli).
Im Nierenkörperchen befindet sich das Glomerulum, ein Gefäßknäuel, durch dessen gefensterte Kapillarwände der Primärharn abfiltriert wird. Der Primärharn tritt aus dem Nierenkörperchen in den proximalen Tubulus und in die Henlesche Schleife über, wo er nach dem Gegenstromprinzip aufkonzentriert wird. Es folgen der distale Tubulus und ein Sammelrohr (Tubulus renalis colligens).
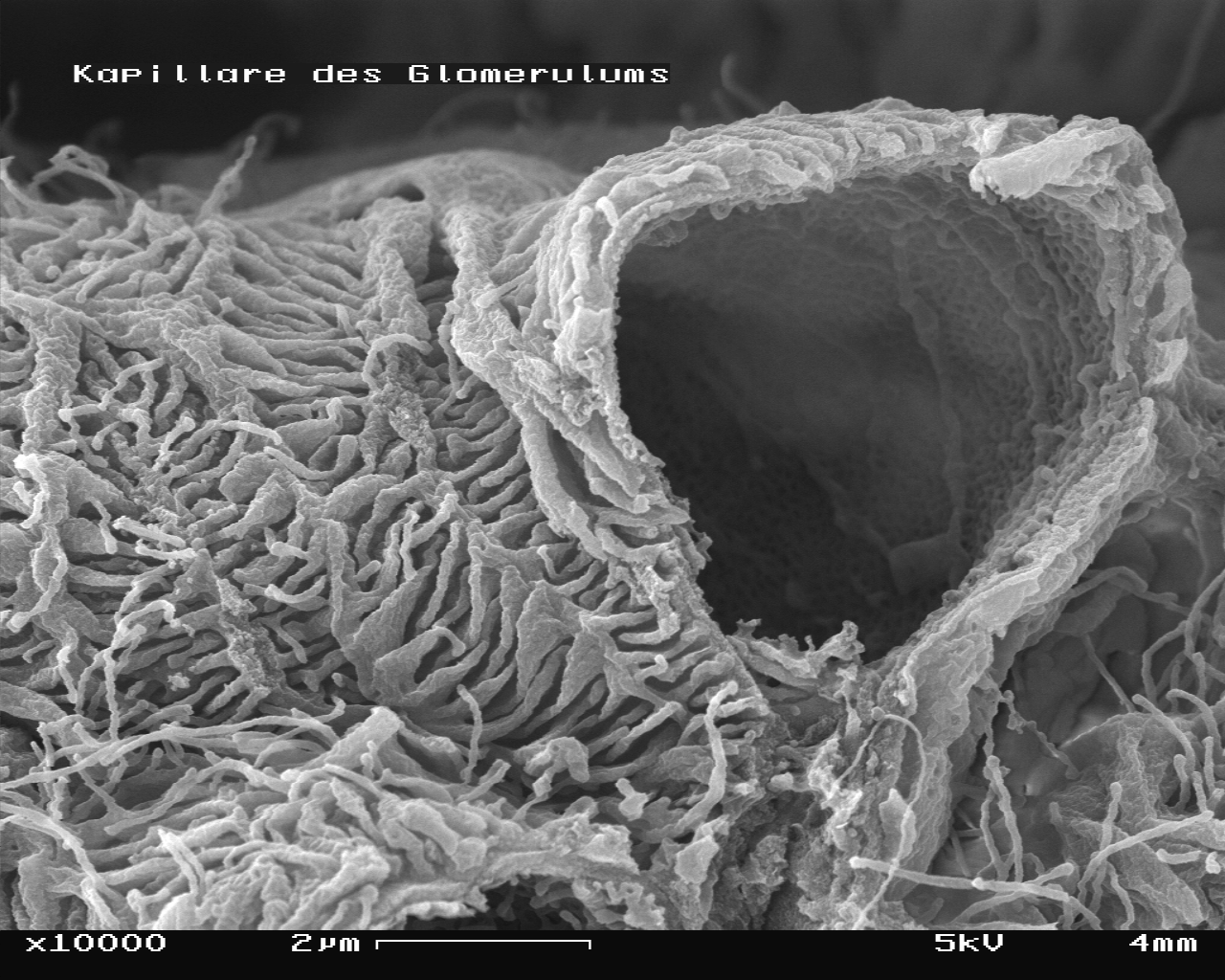
Glomerulus im Rasterelektronenmikroskop (REM)
Bildbreite ca. 115 µmGlomerulus mit gebrochener Kapillare im REM
Bildbreite ca. 11,5 µmEntwicklung
Während der Embryonalentwicklung entstehen bei den Amnioten drei Nierengenerationen: Vorniere (Pronephros), Urniere (Mesonephros) und Nachniere (Metanephros). Die Vorniere übernimmt noch keine Funktion im Embryo. Diese Aufgabe wird erst von der Urniere begonnen und von der Nachniere übernommen. Das Gewebe der Nachniere wächst schließlich zur endgültigen Niere heran. Die Nachniere entsteht aus zwei Anlagen: Dem metanephrogenen Blastem, dem harnbereitenden Abschnitt, und der Ureterknospe, dem harnableitenden Abschnitt. Aus ersterem entsteht das Nierenparenchym mit den Nephronen, in welche die Äste aus der Aorta einsprossen. Aus der Ureterknospe entstehen die Sammelrohre, das Nierenbecken mit den Nierenkelchen und der Ureter.
Die Nieren erfahren aufgrund des Längenwachstums des Embryos einen Aufstieg (Ascensus), also verlagern sich aus dem Bereich des Beckens nach oben. Verwachsen die beiden unteren Nierenpole, kann eine einzelne Hufeisenniere entstehen. Bleibt der Aufstieg der Nieren aus, verbleiben die Nieren als Beckennieren im Bereich des Beckens. Steigt die Niere zu hoch, kann sie im Brustkorb liegen (intrathorakale Niere)[1]. Da sich während der Entwicklung alte Gefäße zurückbilden und neue die Versorgung übernehmen, sind Variationen relativ häufig. Von akzessorischen Nierenarterien spricht man bei einer zusätzlichen Arterie, die in den Hilus mündet, von einer aberranten Arterie, wenn das Gefäß nicht am Hilus, sondern unabhängig – oft an einem Pol – mündet.
Funktion
Aufgaben der Niere
Die Niere...
- reguliert den Wasserhaushalt des Körpers.
- reguliert den Blutdruck langfristig
- scheidet harnpflichtige Substanzen (z.B. Harnsäure, Harnstoff, Kreatinin) und giftige Substanzen (z.B. Medikamente) aus.
- reguliert den Säure-Basen-Haushalt des Körpers. Der pH-Wert des Blutes darf nur in sehr engen Grenzen schwanken, größere Änderungen in Richtung „saurer“ oder „alkalischer“ führen zum Tod.
- reguliert den Gehalt an im Blut gelösten Elektrolyten (Homöostase): Natrium, Kalium, Calcium, Magnesium, Phosphat, Bicarbonat.
- bildet Hormone: Renin (kurzfristige Blutdruckregulation), Erythropoetin (Stimulation der Blutbildung), Calcitriol (Vitamin D, beteiligt am Calcium-Stoffwechsel), Kinine und Prostaglandine.
- ist neben der Leber maßgeblich an der Zuckersynthese (Gluconeogenese) beteiligt.
Messung der Nierenleistung
Die Funktion der Niere kann anhand der Urinmenge, der Urinkonzentration und der Konzentration der harnpflichtigen Substanzen (Kreatinin, Harnstoff, Harnsäure, Kalium) im Blut abgeschätzt werden.
Die genaue Leistung der Nieren wird über die renale Clearance ermittelt. Hierzu gibt es verschiedene Verfahren:
- Die renale Clearance ist ein Maß für die Eliminierung eines Stoffes aus dem Blutplasma, man misst also die Klärfunktion der Niere. Sinkt die Clearance ab, d. h. nimmt die Leistung der Niere ab, spricht man von Niereninsuffizienz.
- Die Inulin-Clearance misst das Filtrationsvermögen der Niere. Hierzu wird dem Patienten Inulin verabreicht und gemessen, wie viel vom verabreichten Stoff pro Zeit wieder ausgeschieden wird. Da Inulin zwar filtriert, nicht aber rückresorbiert wird, ist die Inulin-Clearance identisch mit der glomerulären Filtrationsrate (GFR). Für den gesunden Jugendlichen liegt der Wert bei etwa 125 ml/min. Eine Abnahme des Wertes deutet auf eine Störung in der Nierenfunktion hin (Niereninsuffizienz). Mit zunehmendem Alter nimmt die GFR physiologisch auf 60-65 ml/min ab. Dies ist bei der Dosierung von Arzneistoffen, die über die Niere ausgeschieden werden, wichtig, da bei älteren Patienten durch die geringere GFR oft eine Verringerung der Dosis vorgenommen werden muss.
- Die Creatinin-Clearance wird wegen ihrer einfacheren Durchführung in der Klinik der Inulin-Clearance vorgezogen. Es wird die Ausscheidung von Kreatinin gemessen, die annähernd der von Inulin entspricht. Die Kreatinin-Plasmaspiegel, deren Wert von der Muskelmasse abhängt, schwanken nur wenig, was diese Messung überhaupt erst möglich macht. Vorteilhaft ist weiterhin, dass die Infusion, die bei der Messung der Inulin-Clearance erforderlich ist, entfällt.
Autoregulation der Nierendurchblutung
Die treibende Kraft des Filtriervorgangs ist der in den Glomerulusgefäßen herrschende Blutdruck. Der Blutdruck des Körpers unterliegt normalerweise im Verlauf des Tages typischen Schwankungen: Im Schlaf ist er niedriger als beispielsweise bei körperlicher Anstrengung oder bei Stress. Auch bei bestimmten Erkrankungen, z. B. Diabetes mellitus oder arterieller Hypertonie, ist der Blutdruck erhöht. Für die Filtration in den Glomeruli ist aber ein konstanter Blutdruck wichtig. Deshalb hat die Niere die Fähigkeit, den Blutdruck in ihrem Innern ihren Bedürfnissen anzupassen. Man nennt das auch Autoregulation der Niere oder Bayliss-Effekt.
Die Autoregulation erfolgt mit Hilfe von Drucksensoren (Barorezeptoren), die in den zu- und abführenden Blutgefäßen des Nierenkörperchens sitzen. Bei zu hohem Blutdruck werden die zuführenden (afferenten) Arterien enger gestellt und sorgen so für einen konstanten Blutdruck in den dahinterliegenden Gefäßen des Nierenkörperchens. Ist der Blutdruck zu niedrig, so werden die vom Glomerulus abgehenden Gefäße enger gestellt. Das erhöht den Blutdruck im Glomerulus auf den gewünschten Wert.
Normale Blutdruckschwankungen bleiben ohne Auswirkung auf die Nieren. Auf diese Weise können Schwankungen des systolischen Blutdrucks zwischen 80–180 mmHg ohne große Auswirkungen auf die Filtrationsvorgänge der Nieren bleiben. Darüber hinaus können die Nieren aufgrund ihrer empfindlichen Drucksensoren auch den systemischen Blutdruck ständig überwachen und bei Schwankungen regulierend eingreifen (vgl. Blutdruckregulation der Nieren).
Tubuloglomerulärer Feedback (TGF)
Als Tubuloglomerulärer Feedback (TGF) bezeichnet man einen Mechanismus, mit dem die Filtration eines einzelnen Nephrons in der Niere reguliert wird.
Bei Zunahme des NaCl-Gehalts im distalen Tubulus (Mittelstück) kommt es über eine Sensorfunktion der Macula densa, einem Teil des juxtaglomerulären Apparats, zu einer Reduktion der glomerulären Filtrationsrate desselben Nephrons. Dies wird durch eine vom Mesangium vermittelte Vasokonstriktion (Gefäßverengung) der zum Nierenkörperchen hinführenden Arteriolen (Vasa afferentia) realisiert und dadurch eine Verminderung der glomerulären Filtrationsrate erzielt.
Genaugenommen handelt es sich hierbei um einen physiologischen Regulationsmechanismus, der das Einzelnephron vor Hyperfiltration schützen soll und bei einem akuten Nierenversagen „fälschlicherweise“ dadurch aktiviert wird, dass die NaCl-Resorption durch die tubuläre Schädigung stark beeinträchtigt wird. Dies führt zu einer erhöhten Flussrate im distalen Tubulus und/oder zu einem erhöhten NaCl-Angebot im Bereich der Macula densa, was schließlich zur Auslösung des tubuloglomerulären Feedbacks führt.
Untersuchungsmethoden der Niere
- Körperliche Untersuchung
- Betasten
- Beklopfen
- Laboruntersuchungen
- Urinuntersuchung
- Teststäbchen auf Nitrit, Leukozyten, Eiweiß, Blut, Zucker etc.
- Urinsediment
- Kreatinin-Clearance
- Elektrolyte
- Der Urin wird auch per Inaugenscheinnahme und anhand des Geruchs beurteilt
- Blutuntersuchung
- Steinuntersuchungen
- Urinuntersuchung
- Bildgebung
- Ultraschall
- Röntgen Kontrastmitteldarstellung der Niere = iv-Pyelogramm
- CT der Niere
- Magnetresonanztomografie der Niere
- Angiografie der Niere
- Nuklearmedizinische Verfahren
- histologische Untersuchungen
Krankheiten der Niere
Krankhafte Veränderungen des Nierengewebes können die Glomerula (Glomerulonephritiden) oder die Nierentubuli (Tubulointerstitielle Nierenerkrankungen) betreffen. Bei ersteren spielen mehr autoimmune Prozesse eine Rolle, bei letzteren Intoxikationen und Infektionen (akut v.a. bakterielle Infektionen). Daneben können beide durch autoimmune oder metabolische Systemerkrankungen mitbetroffen sein. Genetisch bedingte Erkrankungen betreffen meist die Funktion der Tubuli. Die verschiedenen Prozesse unterscheiden sich klinisch kaum, man unterscheidet zwischen akutem und chronischem Nierenversagen bzw. akuten und chronischen Glomerulonephritiden. Sie führen unbehandelt zu Glomerulosklerose und Niereninsuffizienz mit Dialysepflichtigkeit. Es gibt auch Anlagefehler, Nierentumoren, Nierensteine.
Eine schwere Schädigung der Nieren hat andererseits Störungen der Blutdruck- und Hormonregulation des Organismus zur Folge. Es kommt zu renaler Hypertonie, renalem Vitamin D-Mangel und sekundärem Hyperparathyreoidismus, bei schwerer chronischer Niereninsuffizienz zum urämischen Syndrom mit Organschäden und unter anderem Juckreiz. Die Schädigungen können evtl. durch salz- und eiweißarme Ernährung und viel Trinken verlangsamt werden oder die Dialysetherapie wird notwendig.
Nierenkrankheiten: Systematik
- Glomerulonephritiden / Glomerulopathie (Autoimmunentzündung der Nieren)
- akut (mit Nephritischem Syndrom)
- chronisch (mit Nephrotischem Syndrom)
- C1q Nephropathie
- IgA-Nephritis
- Fokal-Segmentale Glomerulonephritis, siehe unter Nephrotisches Syndrom
- membranöse Glomerulonephritis
- membranoproliferative Glomerulonephritis Typ I, II und III, evtl. durch ein Alport-Syndrom (Defekt des Typ IV-Kollagens, geht einher mit Hämaturie, progredientes Nierenversagen und Innenohrschwerhörigkeit)
- Minimal-Change-Glomerulonephritis
- Tubulointerstitielle Nierenerkrankungen
- akut
- bakteriell Pyelonephritis (Nierenbeckenentzündung)
- viral (Hantaan-Virus)
- parainfektiös (Streptokokken‚ EBV)
- allergisch/toxisch
- chronisch
- Analgetikanephropathie und andere Intoxikationen/Überempfindlichkeitsreaktionen
- Sarkoidose
- akut
- Systemerkrankungen mit Nierenbeteiligung
- Vaskulitiden (autoimmune Gefäßentzündungen)
- Andere Gefäßveränderungen
- Metabolische Beeinträchtigungen
- Erbliche Nierenkrankheiten
- tubuläre Funktionsstörungen
- Bartter-Syndrom (selten)
- Fanconi-Syndrom
- Renal-tubuläre Azidose
- Phosphatdiabetes
- angeborener renaler Diabetes insipidus
- Diabetes renalis
- Zystinurie
- Balkan-Nephritis
- Gitelman-Syndrom
- Morbus Fabry
- glomeruläre Erkrankungen
- Anatomische Anlagefehler
- Doppelniere
- Zystennieren oder Familiäre Zystennieren, medizinisch: Polyzystische Zystennieren (PKD)
- Hufeisenniere
- Markschwammniere
- tubuläre Funktionsstörungen
- Nierensteine und Nephrokalzinose
- Nierenabsenkung (umgangssprachlich „Wanderniere“)
- Tumor
- bösartig: Nierenzellkarzinom
- gutartig: z. B. Angiomyolipom, Onkozytom
Syndrome
- Akutes Nierenversagen
- Chronisches Nierenversagen
- nephrotisches Syndrom und nephritisches Syndrom
- Renale Hypertonie
- Renale Anämie
- nephrogener Vitamin D - Mangel (sekundärer Hyperparathyroidismus)
- Renale Osteodystrophie
- Urämie
- Polyurie‚ Nykturie‚ Polydipsie‚ Oligurie‚ Anurie
Siehe auch
Literatur
- Frank H. Netter, Eckehard Renner: Farbatlanten der Medizin. Bd. 2, Niere und Harnwege, Thieme, Stuttgart 1983, ISBN 3-13-524102-5
- Uwe Gille: Harn- und Geschlechtssystem, Apparatus urogenitalis. In: Salomon/Geyer/Gille (Hrsg.): Anatomie für die Tiermedizin. Enke-Verlag, Stuttgart 2004, ISBN 3-8304-1007-7
- AW Mondorf, JE Scherberich: Bildatlas der normalen Niere, Vieweg Verlag, Wiesbaden, Braunschweig 1986, ISBN 3-528-07926-6
Einzelnachweise
- ↑ Hyewon Hahn et al.: „Quiz Page January 2009: Retrocardiac Mass Identified at Birth.“ American Journal of Kidney Diseases 2009; 53: S. A27-A28 Artikel
Weblinks
Wikimedia Foundation.