- Reserpsäure
-
Strukturformel 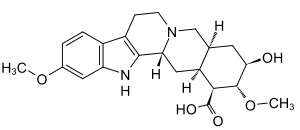
Allgemeines Name Reserpinsäure Andere Namen Reserpsäure
Summenformel C22H28N2O5 CAS-Nummer 83-60-3 PubChem 65747 Kurzbeschreibung kristalliner Feststoff [1] Eigenschaften Molare Masse 400,6 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit löslich in Methanol, Ethanol und Wasser [4]
Sicherheitshinweise Gefahrstoffkennzeichnung [3] 
Giftig (T) R- und S-Sätze R: 25 S: 22-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bei der Reserpinsäure handelt es sich um ein Indolalkaloid aus der Reihe der Epialloyohimbane. Die Struktur wurde 1954 im Rahmen intensiver Beschäftigung mit den Rauvolfia-Alkaloiden aufgeklärt.[5] Erst 1982 wurde Reserpinsäure aus pflanzlichem Material aus Rauvolfia vomitoria isoliert.[1] Davor war sie lediglich als Metabolit des arzneilich genutzten Reserpin bekannt gewesen, aus dem sie durch Hydrolyse der beiden Esterbindungen entsteht und dessen Grundgerüst sie bildet. Reserpinsäure gilt – wie auch die sonstigen Abbauprodukte von Reserpin – als im wesentlichen pharmakologisch inaktiv,[6][7] wenngleich es Hinweise darauf gibt, dass sie wie dieses – jedoch in äußerst geringem Umfang – an vesikuläre Monoamintransporter bindet und damit die Aufnahme von Katecholaminen in Speichergranula stört.[4]
Inhaltsverzeichnis
Reaktionen
Reserpinsäure bildet das Grundgerüst von Reserpin. Aufgrund dieser strukturellen Ähnlichkeit lassen sich aus ihren Reaktionen Rückschlüsse auf die Reserpin-Struktur ziehen. Vor allem zwei Reaktionen trugen zu deren Aufklärung und Zuordnung zu den Epialloyohimbanen bei:
Lactonbildung
Da die Carboxylgruppe am C-16 und die Hydroxygruppe am C-18 der Reserpinsäure leicht miteinander reagieren und dabei unter Wasserabspaltung ein Lacton ausbilden, müssen beide auf derselben Seite des Rings liegen.[8]
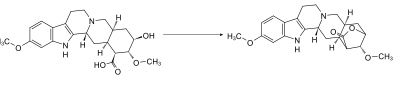 Links die Reserpinsäure mit den cis-ständigen funktionellen Gruppen, rechts das Lacton.
Links die Reserpinsäure mit den cis-ständigen funktionellen Gruppen, rechts das Lacton.Quartärnisierung
Wird die C-16-ständige Carboxylgruppe zuerst mit Lithiumalanat zu einem primären Alkohol reduziert und dieser Alkohol in einem zweiten Schritt mit Tosylchlorid kondensiert, geht das C-22 (das Kohlenstoffatom der reduzierten ehemaligen Carboxylgruppe) spontan eine Bindung mit dem Stickstoffatom in Position 4 ein, wodurch dieses eine positive Ladung bekommt. Zusammen mit dem abgehenden Tosylat-Anion ergibt das entstandene quartäre Amin ein Salz.
Damit der Angriff des partiell positiv geladenen C-22 auf das freie Elektronenpaar des N-4 in dieser Form gelingt, müssen die an die Kohlenstoffatome 15 und 20 gebundenen Wasserstoffatome in α-, das an C-3 gebundene in β-Stellung stehen.[8]
Quellen
- ↑ a b Malik, Afza: Reserpic Acid, Gallic Acid, and Flavonoids from Rauwolfia vomitoria. In: Journal of Natural Products (1983), Vol. 46, Ss. 939ff.
- ↑ Reserpinsäure bei ChemIDplus
- ↑ a b Sicherheitsdatenblatt des Reserpinsäure-Hydrochlorid-Hemihydrats beim Hersteller CarlRoth
- ↑ a b Chaplin, Cohen, Huettl, Kennedy, Njus, Temperley: Reserpic Acid as an Inhibitor of Norepinephrine Transport into Chromaffin Vesicle Ghosts. In: The Journal of Biological Chemistry (1985), Vol. 260, Ss. 10981–10985.
- ↑ Huebner, MacPhillamy, André, Schlittler: Rauwolfia Alkaloids. XV. The Constitution of Reserpic Acid: Position of Substituents in Ring E. In: Journal of the American Chemical Society (1955), Vol. 77, Ss. 472–475.
- ↑ Cohen: Reserpine. In: Sadée (Hrsg.): Drug Level Monitoring. John Wiley & Sons, New York/Chichester/Brisbane/Toronto, 1980. ISBN 047104881X. Ss. 415–417.
- ↑ Hänsel, Sticher: Pharmakognosie – Phytopharmazie. Springer, Heidelberg, 2007. ISBN 3540265082. S. 1421.
- ↑ a b Auterhoff: Lehrbuch der Pharmazeutischen Chemie. Wissenschaftliche Verlagsgesellschaft, Stuttgart, 1983. ISBN 3804707149. S. 399.
Wikimedia Foundation.

