- Rheniumheptaoxid
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Rhenium(VII)-oxid Andere Namen Rheniumheptaoxid
Verhältnisformel Re2O7 CAS-Nummer 1314-68-7 Kurzbeschreibung gelbes Pulver Eigenschaften Molare Masse 484,4 g·mol−1 Aggregatzustand fest
Dichte 6 g·cm−3[1]
Schmelzpunkt Siedepunkt 363 °C[1]
Löslichkeit in Wasser Zersetzung[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Brand-
förderndÄtzend (O) (C) R- und S-Sätze R: 8-34 S: 26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Rhenium(VII)-oxid Re2O7 ist eine chemische Verbindung und zählt zu den Oxiden des Rheniums. Es ist ein gelber hygroskopischer Feststoff. Im Vergleich zum instabilen und explosiven Mangan(VII)-oxid ist Rhenium(VII)-oxid deutlich stabiler.
Inhaltsverzeichnis
Gewinnung und Darstellung
Rhenium(VII)-oxid entsteht beim Erhitzen von Rhenium oder Rheniumverbindungen an der Luft.
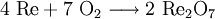
Eigenschaften
Physikalische Eigenschaften
Rhenium(VII)-oxid kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe P212121. Die Gitterkonstanten sind a=125 pm, b=152 pm und c=54 pm. Im Kristall bildet Rhenium(VII)-oxid ReO4-Tetraeder und ReO6-Oktaeder, die sich einander abwechseln und über die Ecken verknüpft sind.[2]
Chemische Eigenschaften
Rhenium(VII)-oxid ist sehr hygroskopisch und löst sich gut in Wasser. Beim Lösen bildet sich die starke Säure Perrheniumsäure.
Verwendung
Rhenium(VII)-oxid ist ein Zwischenprodukt bei der Gewinnung von elementarem Rhenium. Es entsteht beim Rösten von rheniumhaltigen Manganerzen. Das Rhenium(VII)-oxid wird nach der Abtrennung vom übrigen Flugstaub in Wasser gelöst. Aus der dabei entstandenen Perrheniumsäure wird das Rhenium als Ammoniumperrhenat ausgefällt und mit Wasserstoff zum Element reduziert.
Rhenium(VII)-oxid kann als Katalysator in verschiedenen Reaktionen der organischen Chemie verwendet werden. So können mit Hilfe von Rhenium(VII)-oxid Alkane in Carbonsäuren überführt werden.[3] Weitere durch Rhenium(VII)-oxid katalysierte Reaktionen sind Metathese-Reaktionen von Olefinen.[4] Aus Rhenium(VII)-oxid kann der Katalysator Methyltrioxorhenium (MTO) gewonnen werden.[5]
Einzelnachweise
- ↑ a b c d e Sicherheitsdatenblatt (Merck)
- ↑ B. Krebs, A. Müller und H. Beyer: The Crystal Structure of Rhenium(VII) Oxide, in: Inorg. Chem. 1969, 8, 3.
- ↑ M. Kirillova et al.: Group 5–7 transition metal oxides as efficient catalysts for oxidative functionalization of alkanes under mild conditions, in: Journal of Catalysis 2007, 248, 130–136.
- ↑ M. Onaka, T. Oikawa: Olefin Metathesis over Mesoporous Alumina-supported Rhenium Oxide Catalyst, in: Chemistry Letters 2002, 850-851
- ↑ W. Herrmann et al.: Kostengünstige, effiziente und umweltfreundliche Synthese des vielseitigen Katalysators Methyltrioxorhenium (MTO), in: Angew. Chem. 2007, 119, 7440–7442
Literatur
Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1
Wikimedia Foundation.
