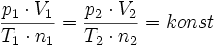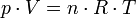- Avogadro-Gesetz
-
Das Avogadrosche Gesetz, auch Gesetz von Avogadro, Avogadrosches Prinzip oder Satz von Avogadro, bezeichnet ein historisches, von Amedeo Avogadro 1811 aufgestelltes Gesetz, nach welchem in gleichen Volumen bei gleicher Temperatur alle Gase eine gleiche Anzahl von Molekülen enthalten, deren Entfernung voneinander im Verhältnis zu ihrer Masse so groß anzunehmen ist, dass sie keine wechselseitige Anziehung aufeinander mehr ausüben.
Avogadro leitete dieses Gesetz aus den von Gay-Lussac gefundenen gesetzmäßigen Beziehungen über die Verbindungen gasförmiger Körper ab. Er unterschied Atome und Moleküle und hob auch hervor, dass beim Übergang der Elemente in den Gaszustand diese sich nur in Moleküle, welche noch aus mehreren einzelnen Atomen bestehen, nicht aber in Atome auflösen.
Inhaltsverzeichnis
Verschiedene Formulierungen des Gesetzes
Gase bestehen aus Molekülen oder im Falle der Edelgase, aus Atomen. Wenn Atome und Moleküle als „kleinste Teilchen“ zusammengefasst werden, gilt:
„Gleiche Volumina aller Gase enthalten bei gleicher Temperatur und gleichem Druck gleich viele kleinste Teilchen.“
„Die molare Gaskonstante hat für alle Gase denselben Wert.“
Aus den Gasgesetzen von Gay-Lussac und Boyle-Mariotte folgt für ein homogenes Gas, das heißt für eine Gassorte, für die Temperatur, Druck oder Volumen variiert wird:
Der Satz von Avogadro besagt nun, dass diese Konstante für alle Gase denselben Wert annimmt, es ist die universelle oder allgemeine Gaskonstante R. Das ist nicht selbstverständlich, denn es bedeutet:
„Dieselbe Teilchenzahl zweier verschiedener Gase übt bei gleicher Temperatur und im gleichen Volumen eingeschlossen immer denselben Druck aus“
Dabei haben verschiedene Gase auch verschiedene große Molare Massen, das heißt, die Teilchen sind unterschiedlich schwer. Schwerere Teilchen bewegen sich bei gleicher Temperatur aber langsamer, ihre Geschwindigkeit ist also geringer. Daher erwartet man, dass die Zahl der Stöße pro Flächeneinheit auf eine Gefäßwand für schwerere Moleküle kleiner ist, jedoch auch, dass der bei einem Stoß übertragene Impuls dementsprechend größer wird. Dabei ist der durch die Stöße resultierende Druck gleich, das heißt die unterschiedlichen Einflüsse gleichen sich gerade aus.Daraus folgt, dass die Gasgleichung
für alle hinreichend verdünnten Gase gilt. Es ist eine allgemeine Gasgleichung, die insbesondere unabhängig von der Molekül- oder Molmasse gilt und damit stoffunabhängig ist.
Eine unzureichende Formulierung
Bisweilen wird fälschlicherweise angenommen, das Avogadrosche Gesetz werde dadurch wiedergegeben, dass das Volumen der Stoffmenge proportional sei, V/n = const. Dies folgt zwar aus dem Gesetz von Avogadro, ergibt sich aber auch ganz einfach, wenn das Gas als homogen, also durch und durch gleichförmig angenommen wird. Aus dieser Annahme folgt sofort, dass zwei gleichgroße Volumen auch dieselbe Stoffmenge enthalten.
Avogadros Gesetz geht aber weit über diese Aussage hinaus, wie oben gezeigt wurde, und ist damit weder trivial noch offensichtlich.
Anwendung des Gesetzes
Eine wichtige Anwendung des Gesetzes ist die Bestimmung von Molekül- oder Molmassen (häufig nicht korrekt als „Molekulargewichte“ bezeichnet) durch Abwiegen eines bekannten Gasvolumens.
Bedeutung
Historische Bedeutung
Avogadros Ansichten gelangten erst fast ein halbes Jahrhundert nach ihrer ersten Formulierung zur Geltung. Man erkannte, dass diejenigen Molekülmassen, welche sich gemäß dem Avogadroschen Gesetz für die einzelnen Verbindungen ergaben, die Analogien derselben am besten hervortreten lassen und mit allen Eigenschaften derselben, chemischen wie physikalischen, am besten übereinstimmen, das heißt man erkannte, dass die mit diesem Gesetz gewonnenen Molmassen korrekt waren. Da die Molmassen von grundlegender Bedeutung sind, gewann man durch dieses Gesetz ein sicheres Fundament für den weiteren Ausbau der Chemie. Avogadros Gesetz war damit von großer Bedeutung, insbesondere für die Chemie im Allgemeinen. Es ist aber auch die Physik bedeutend, vor allem für die kinetische Gastheorie, welche von James Clerk Maxwell vollendet wurde.
Heutige Bedeutung
Heutzutage werden Molmassen praktisch ausschließlich mit Hilfe des Massenspektrometers bestimmt, so dass das Gesetz heute keine direkte praktische Bedeutung mehr besitzt. Es hat aber einen sehr großen didaktischen Wert und ist in der idealen Gasgleichung
– wenn auch versteckt – enthalten, welche natürlich auch heute unabdingbar ist.
Gültigkeitsbereich
Streng genommen ist die Annahme, das molare Volumen sei für jedes Gas 22,4 l, falsch. Zum Einen ergibt sich dieser Wert nur bei einem Druck von 1013,25 hPa und einer Temperatur von 0 °C (oft wird der Wert auch bei Rechnungen benutzt, denen andere Druck- und Temperaturbedingungen zugrunde liegen). Zum Anderen ist das Avogadrosche Gesetz nur eine Vereinfachung für das Modell des idealen Gases. Wenn man das Eigenvolumen der Gasteilchen berücksichtigt, ist logisch, dass gleiche Stoffmengen von verschiedenen Gasen bei gleichem Druck und gleicher Temperatur, aufgrund unterschiedlicher Ausdehnung der Teilchen, nicht das gleiche Volumen einnehmen.
Wikimedia Foundation.