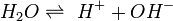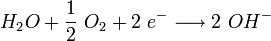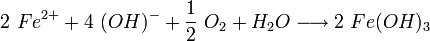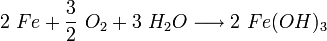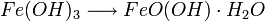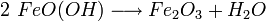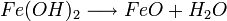- Rostentferner
-
Als Rost bezeichnet man das Korrosionsprodukt, das aus Eisen oder Stahl durch Oxidation mit Sauerstoff in Gegenwart von Wasser entsteht. Rost ist porös und schützt nicht vor weiterer Zersetzung, anders als die Oxidschicht vieler metallischer Werkstoffe wie Chrom, Aluminium oder Zink. Die Verwitterung von Eisenwerkstoffen an Luft und Wasser zu Rost verursacht weltweit jährlich Schäden in Milliardenhöhe.
Inhaltsverzeichnis
Übersicht
Zum Korrosionsschutz werden Eisenwerkstoffe daher lackiert, mit Opferanoden versehen oder auch nachträglich mit Phosphorsäure entrostet (Korrosionsschutz). Chemisch gesehen setzt sich Rost allgemein aus Eisen(II)-oxid, Eisen(III)-oxid und Kristallwasser zusammen, Summenformel:
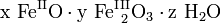 (x, y, z positive Verhältniszahlen).
(x, y, z positive Verhältniszahlen).Rost ist somit ein wasserhaltiges Oxid des Eisens, eine chemische Verbindung, die zu den Oxiden gehört und zusätzlich Wasser und Hydroxidionen enthält (Oxidhydrat). Sie entsteht durch die Oxidation des Eisens, ohne dass höhere Temperaturen erforderlich wären. Rost ähnelt somit der Verbindung Braunstein (wasserhaltiges Mangandioxid), welche ebenfalls als Oxidhydrat eines Übergangsmetalles anzusehen ist.
Rost bildet lockere Gefüge geringer Festigkeit. Die Oxidation bewirkt eine Zunahme der Masse und des Volumens. Letztere führt zu Spannungen und zum Abplatzen der Rostschicht (siehe Abbildung rechts). Betonstähle rosten nicht, wenn sie gut gekapselt im Beton eingebettet sind. Zusätzlichen Schutz bietet das alkalische Milieu von Beton. Wenn aber Wasser und Luft Zutritt zum Stahl erhalten, platzt der Beton infolge der Volumenzunahme des Rostes auf und der Zerfall wird beschleunigt.
Elektrochemisches Modell der Rostbildung
Die Rostbildung (Korrosion) an Eisen beginnt
- durch den Angriff einer Säure (Säurekorrosion) oder
- von Sauerstoff und Wasser (Sauerstoffkorrosion) auf die Metalloberfläche.
Säurekorrosion
Im Fall einer Säure-oder Wasserstoffkorrosion entziehen die Protonen (Wasserstoffionen) der Säure dem Metall Elektronen: Eisen reagiert mit Wasserstoff-Ionen im Wasser (bei A) zu Eisen-II-Kationen :
Die Wasserstoffionen (Oxidationsmittel) reagieren hierbei zu Wasserstoffgas (Redoxreaktion), da sie die Elektronen des Metalles aufnehmen (Reduktion des Oxidationsmittels). Das Reaktionsschema der Gesamtreaktion lautet somit:
Sauerstoffkorrosion
Im Fall einer Sauerstoffkorrosion (Verwitterung des Eisens zu Rost) wirkt Sauerstoff als Oxidationsmittel: Er nimmt Elektronen auf.
In der Schemazeichnung rechts befindet sich auf einer Eisenoberfläche (grau) ein Wassertropfen (blau), umgeben von Luft (weiß). Gemäß der Spannungsreihe der Elemente diffundieren die positiv geladenen Eisenionen in die wässrige Umgebung, die Elektronen verbleiben im Metall und laden es negativ auf (Siehe (1) in der Schemazeichnung). Neutrales Wasser enthält 10-7 mol/L Wasserstoffionen (Autoprotolyse):
Die negative Aufladung des Metalles und die Grenzschicht aus positiv geladenen Eisenionen über der Eisenoberfläche verhindern im Allgemeinen eine schnelle Umsetzung mit Protonen: Sauerstoff- und luftfreies Wasser greifen das Eisenmetall nicht an.
Ist jedoch Sauerstoff vorhanden, kann er den Transport der Elektronen übernehmen. Er diffundiert von außen in den Wassertropfen (siehe Schemazeichnung). Der Konzentrationsunterschied im Wassertropfen erzeugt nun eine Potenzialdifferenz zwischen (2) und (3). Der anodische Bereich (2) und der kathodische Bereich (3) bilden mit dem Wasser als Elektrolyten eine galvanische Zelle, eine Redoxreaktion läuft ab. Die Elektronen reagieren mit Wasser und Sauerstoff zu Hydroxid-Ionen (siehe bei (3) in der Schemazeichnung):
Die Hydroxid-Ionen bilden mit den Eisenionen Eisen(II)-hydroxid (4).
Eisen(II)-hydroxid ist olivgrün bis graugrün, und wird in Gegenwart von Wasser und Luft zu Eisen-III-Ionen umgesetzt. Zusammen mit den Hydroxidionen bildet sich bei dieser zweiten Redoxreaktion rostbraunes Eisen(III)-hydroxid:
Vereinfacht lautet das Gesamt-Reaktionsschema somit:
Durch Wasserabgabe bildet sich hieraus schwerlösliches Eisen(III)-oxid-hydroxid, das sich auf der Eisenoberfläche bei (5) ablagert:
Außerdem finden folgende Vorgänge statt:
Das anfangs gebildete Gemisch aus Eisen(II)-hydroxid und Eisen(III)-hydroxid wird durch teilweise Wasserabgabe zu einer beständigen Mischung aus Eisen(II)-oxid, Eisen(III)-oxid und Kristallwasser umgesetzt, die umgangssprachlich als Rost bezeichnet wird:
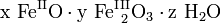 (x, y, z positive Verhältniszahlen)
(x, y, z positive Verhältniszahlen)
Beschleunigende Faktoren bei der Rostbildung
Wenn Eisen mit einem anderen Metall in Berührung kommt, entsteht an der Kontaktstelle ein Lokalelement, das zur Korrosion des unedleren Metalls führt. Der Rostvorgang wird zudem durch die Anwesenheit von Salzen beschleunigt, da diese die Leitfähigkeit des Wassers erhöhen. Die Wanderung der Ionen im Wasser ist wichtig für den Korrosionsprozess, andernfalls wäre der Stromkreis unterbrochen und die Korrosion käme sehr schnell zum Erliegen (vgl. Salzbrücke in einer normalen elektrochemischen Zelle).
Oxidations- und Korrosionvorgänge, die der Rostbildung ähneln
Wasserfreie Oxidationsprodukte, die sich bei hohen Temperaturen auf der Oberfläche von Eisen bilden, werden als Zunder bezeichnet. Sie bestehen anders als Rost aus Wasser- bzw. Hydroxid-freien Eisenoxiden unterschiedlicher Oxidationsstufen. Besonders beim Schmieden von glühendem Eisen platzen durch Hammerschläge von der Oberfläche dünne grauschwarze Eisenoxidschichten ab, die als Hammerschlag bezeichnet werden.
Auch bei anderen Metallen, wie Zink, Chrom, Aluminium oder Nickel, die teilweise auch unedler als Eisen sind, oxidieren nur die obersten Atomlagen zu einer kaum sichtbaren Oxidschicht, die das darunterliegende Metall vor weiterer Reaktion mit Sauerstoff abschirmt (siehe auch Passivierung). In Gegenwart von Luft und Wasser können jedoch auch Verwitterungs- und Korrosionsvorgänge eintreten, so z. B. bei Kupfer zu Patina. Beim Eisen jedoch kommt die Korrosion an der Rost/Materialgrenzfläche nicht zum Stillstand, weil die elektrische Leitfähigkeit des schon gebildeten (feuchten) Rostes und seine Sauerstoffdurchlässigkeit die weitere Korrosion an der Grenze Rost/Material begünstigen.
Bei Temperaturen › 180 °C bilden sich auf Oberflächen von Eisenwerkstoffen bei Einwirkung von Wasserdampf mit hoher Temperatur Schutzschichten aus Magnetit ( Fe3O4 ). Das Magnetit wird durch Reaktion von metallischem Eisen mit Wassermolekülen unter Bildung von Wasserstoff gebildet. Bei Rohren in Hochdruckkesseln mit örtlich sehr hoher Wärmebelastung kann diese Reaktion verstärkt ablaufen und ist manchmal eine der Ursachen von Rohrreissern. Hohe pH-Werte des Wassers, insbesondere in Gegenwart von Alkaliionen, beschleunigen diese Reaktion zusätzlich.
Entrostung
Stark gerostete Metalle können durch Bürsten oder Schleifen von Rost befreit werden. Eine der wirkungsvollsten Methoden für die Entrostung ist das Strahlen mit Sand oder ähnlichen Materialien, die frei von Kieselsäure sind. Diese Methode wird in der Technik vor einem Anstrich überwiegend angewendet. Die vollständige Entfernung von Rost bis auf das blanke Metall ist eine der Voraussetzungen, dass ein korrosionsbeständiger Anstrich erreicht werden kann.
Leichter Rost lässt sich auch mit einer schwachen Säure abwaschen. Geeignet ist beispielsweise verdünnte Phosphorsäure. Damit die Säure das Metall nicht angreift, muss sie danach mit viel Wasser abgespült werden. Das Metall muss gründlich getrocknet und vor weiterer Korrosion geschützt werden. Phosphorsäure dient auch als Rostumwandler und wird in verschiedenen Mischungen für die Instandsetzung etwa von Autos eingesetzt.
Korrosionsschutz
Aus dem Modell lassen sich drei Strategien für den Korrosionsschutz ableiten:
Fernhalten von Sauerstoff
Beispiel: Heizungsrohre aus Eisen rosten innen nicht, wenn das Wasser in einem geschlossenen System ohne Luftzutritt geführt wird. Zudem sinkt die Löslichkeit von Sauerstoff mit steigender Erwärmung des Wassers und erreicht bei 111,6°C ein Minimum. Über dieser Temperatur hinaus steigt allerdings das Lösungsvermögen für Sauerstoff wieder deutlich an.
Man kann diesen Reaktionen aber auch durch verschiedene andere Schutzmaßnahmen vorbeugen. Ein Beispiel dafür ist die Passivierung: das Überziehen mit solchen unedleren Metallen, die eine stabile Oxidschicht bilden. Ein Metall kann ebenfalls durch Galvanisieren, Verzinken oder Verchromen mit einem anderen Metall als Schutzschicht gegen Oxidation versehen werden. Weitere Schutzüberzüge sind diffusionsdichte und porenfreie Anstriche und Beschichtungen mit Kunststoffen und Schleuderbeton.
Fernhalten von Feuchtigkeit
 Getränkedose aus Weißblech mit Rostdurchbrüchen durch die Zinn-Schutzschicht.
Getränkedose aus Weißblech mit Rostdurchbrüchen durch die Zinn-Schutzschicht.Da Wasser als Elektrolyt in der Reaktion zur Rostentwicklung wirkt, ist das Trockenhalten eine gute Gegenstrategie. So gibt es beispielsweise in Ländern mit geringer Luftfeuchtigkeit praktisch keine Rostschäden an Autos.
Eine weitere Möglichkeit sind Schutzschichten aus Fett, Lack,Chrom oder Metallauflagen, die das Eisen von der Umgebung abschirmen (Feuerverzinken, Weißblech). Sobald diese Schutzschicht zerstört wird, beginnt der Rostungsprozess, siehe Bilder links und rechts.
Nichtrostender Stahl ist eine Eisenlegierung mit einem Chromanteil von mehr als 12 % und wird durch die Chromoxidschicht vor Oxidation geschützt.
Abbau der Potenzialdifferenz in Lokalelementen
Beispiel 1: Feuerverzinkung schützt Eisen nachhaltig vor Rostbefall. Kommt es zu einer Schädigung der Beschichtung, bilden Zink und Eisen bei Zutritt von Wasser ein Lokalelement (ähnlich einer Batterie). Zink als das unedlere Metall korrodiert und bewahrt das Eisen vor Oxidation. In den meisten Zinkstaubfarben kann das Zink dagegen nicht galvanisch wirken, da es vom Bindemittel isoliert wird. Nur Zinkstaubfarben mit elektrisch leitendem Bindemittel oder Zinkstaubfarben auf Epoxidharz-Basis mit geeigneter Pigment-Volumen-Konzentration (PVK), bei der sich die Zinkteilchen berühren, schützen gut vor Korrosion.[1]
Bei einer Beschichtung mit einem edleren Metall (zum Beispiel Zinn bei Weißblech) tritt der umgekehrte Fall ein. Das Eisen rostet, möglicherweise verdeckt von der Schutzschicht (siehe Bild der Getränkedose). Die Anwesenheit eines edleren Metalls fördert sogar die Oxidation. Das Lokalelement aus Eisen und dem edleren Metall verhindert die schützende negative Aufladung des Eisens (siehe oben).
Beispiel 2: Eisenrohre werden elektrisch mit einer sogenannten Opferanode aus einem unedleren Metall verbunden. Wie im ersten Beispiel wird Eisen auf Kosten der Opferanode geschützt, sofern beide über einen Elektrolyten, zum Beispiel feuchtes Erdreich, im Kontakt stehen.
Beispiel 3: Statt einer Opferanode schützt auch eine elektrisch leitende Elektrode (zum Beispiel Graphit), wenn sie über eine externe Gleichspannungsquelle auf einem positiven Potenzial relativ zum Eisen gehalten wird.
Siehe auch
- Flugrost
- Limonit
- Oxide
- Oxidation, Redoxreaktion
- Korrosion
- Kupferpatina (Korrosion von Kupfer)
- Weißrost (Korrosion von Zink)
- Eloxieren (Oberflächenoxidation von Aluminium)
Einzelnachweise
- ↑ G. Meichsner, T. Mezger, J. Schröder: Lackeigenschaften messen und Steuern: Rheologie- Grenzflächen- Kolloide. Vincentz Network, 2003, ISBN 9783878707394
Literatur
- Werner Schatt: Einführung in die Werkstoffwissenschaft. Deutscher Verlag für Grundstoffindustrie, Leipzig 1991. ISBN 3-342-00521-1
- Günter Schulze, Hans-Jürgen Bargel: Werkstoffkunde. Schroedel, Hannover 1978, Springer, Berlin 72000. ISBN 3-540-66855-1
- Hömig: Physikochemische Grundlagen der Speisewasserchemie, Vulkan Verlag Dr. W. Classen, Essen 1963
Weblinks
- Chemische Experimente zur Korrosion
- www.wissenschaft.de: Wie Rost nützlich wird - Eisenoxid kann in Form von Nanopartikeln helfen, Trinkwasser zu säubern
Wikimedia Foundation.





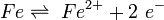
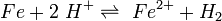 (
(