- S-Adenosyl-Methionin
-
Strukturformel 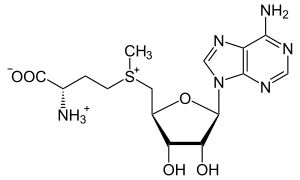
Allgemeines Name S-Adenosylmethionin Andere Namen - SAM
- SAMe
- AdoMet
- S-Adenosyl-L-Methionin
Summenformel C15H23N6O5S CAS-Nummer 29908-03-0 Eigenschaften Molare Masse 399,145 g/mol Löslichkeit gut löslich in polaren Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. S-Adenosylmethionin, kurz SAM oder AdoMet genannt, ist ein wichtiges Schlüsselprodukt im Stoffwechsel der Aminosäure Methionin. Es entsteht aus dieser durch eine Reaktion mit Adenosintriphosphat (ATP). SAM tritt im Stoffwechsel als Methylierungsmittel auf, wobei es selbst über S-Adenosylhomocystein zu Adenosin und Homocystein hydrolysiert wird. Homocystein kann wieder zu Methionin remethyliert oder zur Aminosäure Cystein abgebaut werden, deren weiterer Abbau über mehrere Zwischenschritte als Succinyl-CoA in den Citronensäurezyklus einmündet.
Inhaltsverzeichnis
Geschichte
S-Adenosylmethionin wurde von Cantoni 1952 entdeckt und von eben diesem in seiner Bedeutung und Chemie erforscht.[2] Erst in den letzten Jahren wurde seine Bedeutung als Arzneistoff erkannt.[3] In den USA wird S-Adenosylmethionin als Nahrungsergänzung verkauft. Dies wurde möglich durch den Dietary Supplement Health and Education Act von 1999. Dieses Gesetz erlaubt für Nahrungsergänzungsstoffe die Umgehung der Food and Drug Administration (FDA).
Biosynthese
SAM wird in den Zellen aus Methionin und ATP durch das Enzym Methionin-Adenosyl-Transferase in Anwesenheit von Mg2+-Ionen synthetisiert.[2]
Eigenschaften und Biologische Bedeutung
Die hochreaktive Methylgruppe an der Sulfonium-Gruppe des SAM ist im Stoffwechsel an sogenannten Transmethylierungen beteiligt, bei denen eine Methylgruppe übertragen bzw. eingeführt wird. Diese Reaktionen werden durch Enzyme namens Methyltransferasen katalysiert, die SAM als Substrat verwenden.[4] Solche Transmethylierungen sind wichtige Schritte bei der Biosynthese verschiedener Neurotransmitter, wie Adrenalin oder Acetylcholin. Auch die besser als Lecithin bekannten Phosphatidylcholine benötigen für ihre Darstellung SAM. Der Neurotransmitter Histamin wird u. a. durch die SAM-abhängige Histamin-N-Methyltransferase inaktiviert. Weiterhin spielt SAM bei der DNA-Methylierung durch DNA-Methyltransferasen in Eukaryonten eine wichtige Rolle.[2]
Medizinische Anwendung
Das breite Wirkungsspektrum von SAM als Arzneistoff umfasst die Behandlung von Depressionen, Arthritis und Lebererkrankungen.[3]
Nebenwirkungen
Folgende Nebenwirkungen können bei der Behandlung mit SAM auftreten: Magenbeschwerden, Durchfall, Ängstlichkeit, manische Symptome, Kopfschmerzen, Schlaflosigkeit und allergische Reaktionen.[5] Die nach einer Langzeittherapie auftretenden Auswirkungen sind unbekannt.
Induzierung manischer Symptome
Bei Menschen mit bipolaren Störungen besteht nach oraler Einnahme von SAM die Gefahr der Ausbildung manischer Symptome, wie dies auch bei anderen Antidepressiva möglich ist. Klinische Studien haben ebenfalls gezeigt, dass orale oder injizierte Gaben der Verbindung auch bei Patienten ohne vorher diagnostizierte Bipolare Störungen manische Symptome hervorrufen können.[6] Manche Symptome wie kognitive Dysfunktionen können auch nach Absetzen der Medikation weiterbestehen.[7]
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Julia Nina Kirschler: Einflüsse von NAD/NADH+ auf SAH. Dissertation, 2006.
- ↑ a b Agency for Healthcare and Quality: SAM als Arzneistoff
- ↑ Sandra Christine von Hippel: Der Einfluss von Hypoxie auf Methylierungen. Dissertation, 2006.
- ↑ Najm, W.I. et al. (2004): S-adenosyl methionine (SAMe) versus celecoxib for the treatment of osteoarthritis symptoms: a double-blind cross-over trial. [ISRCTN36233495]. In: BMC Musculoskelet. Disord. Bd. 5, S. 6. PMID 15102339 doi:10.1186/1471-2474-5-6
- ↑ Goldberg, Ivan (Revised 27 May 2006). S-adenosyl-L-methionine as an Antidepressant (Results of a MEDLINE Search). Dr. Ivan's Depression Central.
- ↑ Jamison, Kay (Updated Jan 21, 2004). Brain Damage in Depression and Bipolar Disorder. McMan's Depression and Bipolar Web.
Wikimedia Foundation.
