- Sabatier Verfahren
-
Der Sabatier-Prozess oder die Sabatier-Reaktion, benannt nach dem französischen Chemiker Paul Sabatier, beschreibt eine chemische Reaktion bei der Kohlendioxid und Wasserstoff in Methan und Wasser umgewandelt wird. Sie wird durch folgende Reaktionsgleichung beschrieben
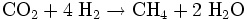 .
.Bei erhöhter Temperatur und erhöhtem Druck läuft die Reaktion unter Verwendung eines Nickel-Katalysators ab, effektiver ist die Verwendung von Ruthenium auf einem Aluminiumoxid Substrat. Oft ist auch ein Sabatier-Prozess in Verbindung mit einer nachgeschalteten Wasserstoff-Elektrolyse technisch relevant, da sich so Methan und Sauerstoff erzeugen lassen. Die Reaktionsgleichung lautet dann
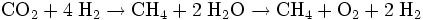 .
.Lebenserhaltende Systeme von Raumfahrzeugen und Raumstationen
Zur Zeit wird auf der Internationale Raumstation Sauerstoff aus der Elektrolyse von Wasser gewonnen. Hier bei wird der überschüssige Wasserstoff ins All entlassen. Bei dem Verbrauch des Sauerstoffes durch die Astronauten wird Kohlenstoffdioxid frei, welches chemisch gebunden wird und so dem Prozess entnommen wird. Diese Lösung setzt voraus, dass regelmäßig relativ große Mengen an Wasser zur ISS transportiert werden, welche dann zur Sauerstoffgewinnung, aber auch für den Verzehr, Hygiene und Weiteres verwendet werden. Bei der Planung zukünftiger, längerer Missionen und zur Verringerung des Wasserbedarfs werden Alternativen zu dem bisherigen Konzept untersucht.
Beispielsweise erforscht die NASA zur Zeit die Anwendung einer Sabatier-Reaktion um das Wasser aus dem ausgeatmeten CO2 zurück zu gewinnen. Das zusätzliche Produkt, Methan, würde vermutlich ins All entlassen. Da die Hälfte des benötigten Wasserstoffes in Form von Methan verloren gehen würde, müsste Wasserstoff in regelmäßigen Abständen nachgeliefert werden. Dennoch würde so der Kreislauf deutlich besser geschlossen, und entsprechend wenig Wasserstoff im Vergleich zum bisherigen Prozess der das deutlich schwerere Wasser verwendet, benötigt.
Die Reaktionsgleichungen des Prozesses stellen sich wie folgt dar:
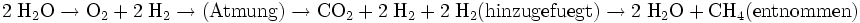
Bemerkenswert ist, dass der Kreislauf komplett geschlossen werden könnte, wenn das überschüssige Methan durch Pyrolyse in seine Elemente zerlegt werden könnte:
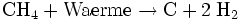
Der durch die Pyrolyse gewonnene Wasserstoff könnte zurück in den Sabatier-Prozess geführt werden. Als Produkt bliebe lediglich eine Ablagerung aus Kohlenstoff in der Form von Graphit. Der Pyrolyse-Reaktor könnte als ein Stahlrohr ausgeführt werden, welches in gewissen Abständen von einem Astronauten gereinigt (z.B. ausgekratzt) werden müsste. Dieser Prozess ließe sich eventuell auch automatisieren.
Die Bosch-Reaktion welche über den direkten Weg
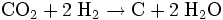
Wasser erzeugt, wird auch für die beschriebene Anwendung untersucht. Die Abscheidung von festem Kohlenstoff auf dem Katalysator bereitet zur Zeit jedoch noch Probleme, da durch diese die effektive Fläche des Katalysators herabgesetzt wird.
Herstellung von Raketentreibstoff auf dem Mars
Der Sabatier-Prozess mit nachgeschalteter Elektrolyse des Wasser (s.o.) wurde als entscheidender Faktor zu Kostenreduzierung bei (bemannten) Mars-Missionen identifiziert. Hierbei wird durch Nutzung der vor Ort vorhandenen Ressourcen (In-Situ Resource Utilization) Raketentreibstoff in Form von Methan und Sauerstoff produziert und eingelagert. Verbraucht werden der von der Erde mitgebrachte Wasserstoff sowie Kohlendioxid, welches den Hauptbestandteil der Marsatmosphäre bildet. Die stöchiometrische Mischung der Treibstoffkomponenten liegt bei 3,5:1 (Massenanteile) Sauerstoff zu Methan, wobei durch den einfachen Sabatier-Prozess lediglich ein Wert von 2:1 erreicht wird. Um die Sauerstoffausbeute zu erhöhen, bietet es sich an zusätzlich die Wassergas-Shift-Reaktion in umgekehrter Reihenfolge ablaufen zu lassen, wobei sich folgende Reaktionsgleichung ergibt
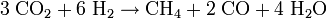 .
.Die Reaktion ist leicht exotherm, und durch Elektrolyse des Wassers ließe sich ein Mischungsverhältnis von 4:1 (leichter Sauerstoffüberschuss) erreichen. Alternativ ließe sich das bei der Sabatier-Reaktion erzeugte Methan teilweise pyrolysieren (siehe vorheriger Abschnitt). Der entstehende Wasserstoff könnte erneut im Sabatier-Reaktor verwendet werden um das gewünschte Produktmengen-Verhältnis zu erreichen. Zur praktischen Durchführung ist es geplant in einer vorgelagerten, unbemannten Mission einen Reaktor zum Mars zu transportieren, der Methan und Sauerstoff als Treibstoff herstellt. Dieser kann von den nachfolgenden, bemannten Mission für Expeditionen auf dem Mars und für den Rückflug genutzt werden. Entscheidend ist, dass durch Anwendung der beschrieben Technologien eine Gewichtsreduzierung von 18:1 erzielt werden kann. Dieses ist dadurch möglich, dass nur noch das leichte Element Wasserstoff zum Mars transportiert werden muss, die vergleichsweise schwereren Elemente Kohlenstoff und Sauerstoff jedoch vor Ort (in situ) gewonnen werden.
Weblinks
Wikimedia Foundation.
