- Sek-Butylglycin
-
Strukturformel 
L-IsoleucinAllgemeines Name Isoleucin Andere Namen - Ile (Dreibuchstabencode)
- I (Einbuchstabencode)
- α-Amino-β-methylvaleriansäure
- (2S,3S)-2-Amino-3-methylpentan-säure
Summenformel C6H13NO2 CAS-Nummer - 73-32-5 L-Isoleucin
- 319-78-8 D-Isoleucin
- 1509-34-8 L-allo-Isoleucin
- 1509-35-9 D-allo-Isoleucin
PubChem 791 ATC-Code V06[1]
DrugBank NUTR00031 Kurzbeschreibung farbloser Feststoff mit schwachem Geruch [1] Eigenschaften Molare Masse 131,17 g·mol−1 Aggregatzustand fest
Schmelzpunkt Zersetzung: 284 °C ((L-Isoleucin)[1]
pKs-Wert - pKCOOH: 2,32 (L-Isoleucin)
- pKNH2: 9,76 (je bei 25 °C) (L-Isoleucin)[2]
Löslichkeit löslich in Wasser: 40 g·l−1 (20 °C) ((L-Isoleucin)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. L-Isoleucin ist eine essentielle proteinogene α-Aminosäure, die zur Aspartatgruppe zählt, sich also von der Asparaginsäure ableitet.
Isoleucin besitzt zwei Stereozentren, somit existieren vier Stereoisomere, in unserer Umwelt spielt jedoch nur das L-Isoleucin als proteinogene Aminosäure eine Rolle und ist physiologisch bedeutsam.
L-Leucin, L-Norleucin und L-tert-Leucin sind Konstitutionsisomere des L-Isoleucins und des L-allo-Isoleucins. Das gilt auch für deren Isomere mit D-Konfiguration.
Inhaltsverzeichnis
Geschichte
L-Isoleucin wurde erstmals 1904 von Felix Ehrlich aus entzuckerter Melasse isoliert.
Vorkommen
Beim Aufbau von Proteinen macht der Anteil an L-Isoleucin im Durchschnitt 4,6 % aus, die empfohlene Tagesdosis liegt bei 1,4 g. Der normale Blutwert liegt bei Erwachsenen im Bereich 30–100 µmol/l, im Urin 10–180 µmol/l Kreatinin.
Als Beispiel hier der Isoleucingehalt einiger Lebensmittel je 100 Gramm:
- Weizenkeime 1,32 g
- Thunfisch 1,21 g
- Erdnüsse 1,23 g
- Lachs 1,16 g
- Rindfleisch, Filet 1,09 g
- Kalbfleisch, Filet 1,11 g
- Kichererbsen 1,14 g
Eigenschaften
Isoleucin liegt am isoelektrischen Punkt (einem bestimmten pH-Wert) als Zwitterion (inneres Salz) vor, d. h. das Proton der Carboxylgruppe (–COOH) ist abdissoziiert und protoniert die Aminogruppe (–NH2).
- Seitenkette: lipophil
- isoelektrischer Punkt: 5,94[3]
- van-der-Waals-Volumen: 124
- Lipidlöslichkeit: LogP = 4,5
Stereochemie
Isoleucin besitzt zwei Stereozentren, somit existieren vier Stereoisomere, in unserer Umwelt spielt jedoch nur das L-Isoleucin [Synonym: (2S,3S)-Isoleucin] als proteinogene Aminosäure eine Rolle. Enantiomer zum natürlichen L-Isoleucin ist das D-Isoleucin [Synonym: (2R,3R)-Isoleucin]. L-allo-Isoleucin [Synonym: (2S,3R)-allo-Isoleucin] und dessen Enantiomer D-allo-Isoleucin [Synonym (2R,3S)-allo-Isoleucin] sind Diastereomere der proteinogenen Aminosäure L-Isoleucin. Allein das L-Isoleucin (2-Amino-3-methylvaleriansäure) mit (2S,3S)-Konfiguration ist physiologisch bedeutsam.


L-Isoleucin (2S,3S) bzw. D-Isoleucin (2R,3R) 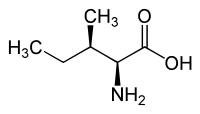
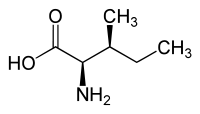
L-allo-Isoleucin (2S,3R) bzw. D-allo-Isoleucin (2R,3S) Gewinnung
L-Isoleucin wird vorwiegend durch Fermentation von Glukoselösungen hergestellt, die L-Threonin enthalten.[4][5] Durch Hydrolyse von Proteinhydrolysaten und nachfolgende Trennoperationen erhält man ein Gemisch der natürlichen Aminosäuren L-Leucin und L-Isoleucin. Diese Konstitutionsisomeren lassen sich z. B. nach einem enzymatischen Verfahren trennen.[6]
Verwendung
Als Bestandteil von Aminosäure-Infusionslösungen [Aminoplasmal® (D), Aminosteril®-N-Hepa (D), Primene® (A)] zur parenteralen Ernährung findet L-Isoleucin, neben anderen Aminosäuren, breite Anwendung in der Humanmedizin. Für Patienten mit gestörter Verdauung wurde eine oral anzuwendende „chemisch definierte Diät“ entwickelt, die L-Isoleucin enthält. In dieser Diät bilden die Aminosäuren die Stickstoffquelle; alle lebensnotwendigen Nährstoffe liegen in chemisch genau definierter Form vor.[4]
Einzelnachweise
- ↑ a b c d Eintrag zu L-Isoleucin in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 19. Januar 2008 (JavaScript erforderlich).
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, S. 823.
- ↑ Bernd Hoppe und Jürgen Martens: Aminosäuren – Herstellung und Gewinnung, in: Chemie in unserer Zeit 1984, 18, 73–86.
- ↑ a b Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, in: Angewandte Chemie 1987, 90, 187–194; Angewandte Chemie International Edition in English 1978, 17, 176–183.
- ↑ Hitoshi Enei, Kenzo Yokozeki und Kunihiko Akashi: Recent Progress in Microbial Production of Amino Acids, Gordon & Breach Science Publishers 1989, ISBN 978-2-88124324-0, S. 1–160.
- ↑ Jürgen Martens und Horst Weigel: Enzymatic Separation of L-Leucine and L-Isoleucine, in: Liebigs Annalen der Chemie 1983, 2052–2054.
Weblinks
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.
