- Short hairpin RNA
-
Unter RNA-Interferenz (RNAi, auch RNA-Silencing) versteht man einen natürlichen Mechanismus in eukaryotischen Zellen, der die Genexpression einzelner Gene hemmt. Bei dieser Genregulation ist immer RNA als zielerkennendes Molekül beteiligt. Nach neuesten Erkenntnissen kann die RNA-Interferenz auf unterschiedlichen Ebenen eintreten: auf Chromatin-Ebene, post-transkriptionell oder translationell.
Gemeinsam ist diesen regulatorischen Mechanismen das circa 21-23 nt lange einzelsträngige RNA-Molekül, das für die genspezifische Herabregulation verantwortlich ist. RNAi führt zur Spaltung, zur Translationsblockade der Ziel-mRNA oder zum Methylieren und Abschalten des entsprechenden Gens. Somit wird die Produktion spezifischer Proteine reduziert. Dies spielt in der Genregulation eine bedeutende Rolle, aber auch in der Abwehr von Viren (v. a. bei Pflanzen).
Als zielerkennende RNA kann miRNA (auch microRNA genannt), siRNA oder piRNA wirken. Der Unterschied liegt in der Herkunft der beiden kleinen RNAs. So wird miRNA in der Zelle auf eigenen pri-miRNA-Genen codiert, die siRNA hingegen entsteht aus längerer freier dsRNA, die z. B. von Transposons oder von Viren stammen.
Für die Entdeckung des Mechanismus der RNA-Interferenz erhielten die beiden US-Wissenschaftler Andrew Z. Fire und Craig C. Mello 2006 den Nobelpreis für Physiologie oder Medizin.
Inhaltsverzeichnis
Quellen interferierender RNA
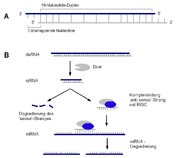
Eine Quelle von interferierenden RNAs sind siRNAs, die durch den RISC-Komplex erzeugt werden. Dieser schneidet doppelsträngige RNA, die meist aus Transposons oder RNA-Viren stammt, in kurze doppelsträngige Fragmente.
Die miRNA dagegen wird innerhalb des Genoms und durch RNA-Polymerase II transkribiert. Diese Gene liegen isoliert in Clustern oder in Introns vor, dabei stammen die miRNAs teils aus den Introns der durch die miRNA regulierten Gene. Bei der Transkription der miRNA-Gene wird das pri-miRNA genannte Transkript mit 5'-Cap-Struktur und 3'-Poly-(A)-Schwanz versehen. Durch einen nukleären Enzymkomplex (Microprocessor complex) wird hieraus ein strukturell einheitliches Fragment von 60-75 nt Länge geschnitten, die prä-miRNA. Diese verfügt typischerweise über zwei lange entgegengesetzt laufende Abschnitte RNA, die eine Haarnadelstruktur bilden, und einer etwa 10-20 nt langen Schleife. Die prä-miRNA wird durch Exportin5 ins Cytoplasma exportiert. Dort wird innerhalb des RISC-Komplexes durch die Ribonuklease „Dicer“ aus der prä-miRNA die doppelsträngige, 21 nt lange miRNA geschnitten.
RISC
RISC macht - im Überblick - folgendes: Die dsRNA bzw. hairpin-RNA wird zu einer 21-nt-dsRNA geschnitten (Dicer). Deren einer Strang wird geschnitten und entfernt (Argonaute2). Der verbleibende 21-nt-Einzelstrang bindet (Watson-Crick-Prinzip) spezifisch die Ziel-mRNA. Diese wird endonucleolytisch (Argonaute2) einmalig geschnitten. Die Restfragmente werden durch unspezifische Exonucleasen abgebaut. Dies sind wahrscheinlich charakterisierte RNA- modifizierende Makrokomplexe wie GW-bodies oder Exosomen.
RISC besteht (im Übergangszustand...) aus der Endonuclease Dicer (schneidet die dsRNA zum 21 nt Fragment), der Endonuclease Argonaute2 (schneidet den zweiten Strang der 21 nt dsRNA und die Ziel-mRNA), einem dsRNA-bindenden Protein (TRBP/R2D2/Loquacious/RDE4) und der targetierenden miRNA/siRNA. Dicer dissoziiert, sobald eine mi/siRNA vorliegt.
Dicer, eine Typ-III-Ribonuclease, spielt sowohl bei der Biogenese von siRNAs als auch von miRNAs eine große Rolle, indem sie die circa 21 nt langen RNAs aus größeren Vorläufermolekülen prozessiert. Das Enzym Dicer ist ein Protein (im Menschen 220 kDa groß), das zwei RNase-III-Domänen, eine PAZ-Domäne, eine dsRNA-Bindestelle und eine Helicase-Domäne besitzt. Es liegt in der Zelle assoziiert mit Proteinen der Argonaut-Familie vor, die wichtige Funktionen bei der RNAi wahrnehmen. Dieser Komplex aus Dicer und Ago-Proteinen (sie besitzen eine PAZ-Domäne zur miRNA-Übernahme und eine PIWI-Domäne zum Zerschneiden der Ziel-mRNA) erkennt spezifisch doppelsträngige RNA (lange RNA-Duplices im Falle der siRNA oder aber kurze Hairpin-Strukturen bei der Biogenese von miRNAs, vgl. kleine RNAs) und zerschneidet diese in die charakteristischen circa 21 nt langen si- oder miRNAs. Anschließend werden die kurzen RNA-Doppelstränge unter ATP-Verbrauch entwunden und eine der entstehenden kleinen – nun reifen – RNAs wird bevorzugt in den sogenannten RNA-induced silencing complex (RISC) – einen Ribonucleoprotein-Komplex (RNP) – eingebaut (bzw. der RISC auf dem Dicer-siRNA-Komplex assembliert). Auch hier spielen neben weiteren Proteinen (z. B. RDE-4 in C. elegans) die Ago-Proteine eine große Rolle. Die Auswahl, welcher der beiden komplementären RNA-Stränge schließlich im RISC endet, findet anhand der Stabilität der Enden des RNA-Duplexes statt. Bei mehr oder weniger „symmetrischen“ RNA-Duplices kann man beide RNAs in ähnlichen Mengen in der Zelle nachweisen, bei unterschiedlicher Stabilität der Enden wird eine der beiden RNAs bevorzugt.
Je nach Organismus findet man unterschiedliche Anzahlen von Dicer- und Argonaute-Proteinen, die z.T. unterschiedliche Funktionen wahrnehmen (z. B. miRNA bzw. siRNA-Wege)
In einigen Organismen (wie z. B. Pflanzen, nicht aber im Menschen) findet sich weiterhin eine RNA-dependent RNA polymerase (RdRP), die den Duplex (Doppelstrang) aus siRNA und target-mRNA als Vorlage verwenden kann. So entsteht neue Doppelstrang-RNA, die wiederum von Dicer erkannt und gespalten wird, was zu einem selbstverstärkenden Zyklus führt. In Organismen mit RdRP äußert sich dies darin, dass künstlich in die Zelle eingebrachte Antisense-Einzelstrang-RNA weit weniger effektiv für den gene knockdown ist als dsRNA.Inhibition der Translation
Neben dem Spalten der Ziel-mRNA kommt es bei einigen Zielen der siRNAs (meist bei nicht vollständiger Basenpaarung) zu einer Inhibition der Translation, wobei sehr häufig die Menge der Ziel-mRNA insgesamt fast unverändert bleibt. Wie dies mechanistisch funktioniert, ist weitestgehend unklar; man vermutet aber, dass dies ähnlich wie bei miRNAs funktioniert. Die Daten einiger Forschergruppen argumentieren hier für eine Blockade der Translations-Initiation (häufig einhergehend mit einer Verkürzung des poly-A-Schwanzes der Ziel mRNA), während Daten anderer Gruppen einen Abbau der naszierenden Proteinkette an den elongierenden Ribosomen nahelegen.
Geschichte der Entdeckung
Um das Jahr 1990 versuchte die Forschergruppe um Mol und Jorgensen, die Blütenfärbung von Petunien zu verstärken [1]. Sie beabsichtigten, zusätzliche Kopien des Gens Dihydroflavonol-Reduktase in die Pflanzen einzubringen, und hofften dadurch die Produktion der Blütenfarbstoffe (aus der Gruppe der Flavonoide) anregen zu können. Das Gegenteil war jedoch der Fall. Zur Überraschung aller waren die meisten der genetisch veränderten Pflanzen weniger stark gefärbt als unbehandelte Pflanzen, einige sogar schneeweiß. Für dieses Phänomen wurde zunächst der Begriff „Cosuppression“ geprägt, da nicht nur die in die Pflanzen eingebrachten Gene, sondern auch das korrespondierende, natürlich in den Pflanzen vorkommende Gen der Dihydroflavonol-Reduktase kein bzw. nur wenig funktionelles Protein lieferte.
Weitere Arbeiten zeigten einige Jahre später, dass die Gene nicht nur auf der Ebene der Transkription abgeschaltet wurden, sondern dass zusätzlich die von ihnen produzierte mRNA in den Zellen schnell abgebaut wurde – ein Vorgang, der ‚Post-Transcriptional Gene Silencing’ (PTGS) getauft wurde. Etwa zur gleichen Zeit wurden ähnliche Phänomene aus Pilzen (Neurospora crassa) unter dem Namen ‚Quelling’, aus Algen und Caenorhabditis elegans, einem Fadenwurm (Nematoden), berichtet.
1998 schließlich war nach einer Reihe von Untersuchungen klar, dass die mRNA selbst maßgeblich an dem Phänomen des PTGS beteiligt ist. Fast gleichzeitig – zusammen mit der vollständigen Sequenzierung des Genoms von C. elegans – veröffentlichten Andrew Fire und Craig Mello 1998 die Technik der RNA-Interferenz (RNAi), bei der doppelsträngige RNA (dsRNA) in C. elegans [2] zu einem effizienten und spezifischen Gen-Knockdown führt, wofür ihnen der Nobelpreis für Physiologie oder Medizin des Jahres 2006 zuerkannt wurde. Wie genau das Einbringen von dsRNA in den Organismus jedoch zum Abbau der Ziel-RNA führt, wurde erst klar, als 1999 Hamilton und Baulcombe kurze RNAs mit einer Länge von ca. 25 Nukleotiden isolieren konnten [3], die in direktem Zusammenhang zu den regulierten RNAs stehen: die siRNAs (small interfering RNAs), die der RNAi ihre Spezifität verleihen, indem sie die Ziel-RNAs über Basenpaarung binden.
Bei dem Versuch, die von Mello und Fire verwendete Strategie auf Wirbeltiere zu übertragen, traten jedoch in der Folgezeit erhebliche Probleme auf: Die verwendeten Zellen schienen die langen doppelsträngigen RNAs nicht zu tolerieren, und es kam zum programmierten Zelltod (Apoptose), ausgelöst durch die PKR (Protein-Kinase R). Erst 2001 veröffentlichten Sayda Elbashir und Thomas Tuschl einen Weg, wie dieses Problem umgangen werden kann [4], indem kurze dsRNAs von 21 nt Länge verwendet wurden, die nicht zu einer Aktivierung von PKR führen, für einen knockdown jedoch funktionell ausreichend sind.
Da postuliert wurde, dass siRNAs bei der Abwehr von RNA-Viren und bei der Regulation einiger mobiler genetischer Elemente (Transposons) eine Rolle spielen könnten, versuchte man noch im gleichen Jahr – motiviert durch die Tatsache, dass RNAi einen in Eukaryoten wohl universellen Prozess darstellt –, siRNAs aus unbehandelten Zellen zu isolieren. Dabei stieß man jedoch auf eine weitere Gruppe von kleinen RNAs, die micro RNAs (miRNAs). Zwei dieser miRNAs (lin-4 und let-7) waren bereits zuvor in C. elegans entdeckt worden, doch nun zeigte sich, dass dies nur die Spitze des Eisberges war, eine Entdeckung, die im Dezember 2002 im Fachjournal Science als 'Breakthrough of the year' (Durchbruch des Jahres) gefeiert wurde. Heute glaubt man, dass über 474 verschiedene miRNAs mindestens ein Drittel der menschlichen Gene regulieren.
Aus vorausgegangenen Studien an lin-4 und let-7 in C. elegans war bekannt, dass diese miRNAs (zu diesem Zeitpunkt noch als stRNAs – small temporal RNAs – bezeichnet) ähnlich den siRNAs Zielgene über Basenpaarung binden. Nach vorläufigen Erkenntnissen sollten im Gegensatz zu den siRNAs miRNAs jedoch nicht zu einem Abbau der RNA führen, sondern zu einer Repression der Translation. Heute jedoch ist klar, dass miRNAs und siRNAs zwar unterschiedliche Biogenesewege haben, sich in ihrer Wirkung jedoch nur unwesentlich unterscheiden (vgl. kleine RNAs); Erkenntnisse die vor allem Forscherteams um David Bartel, Victor Ambros, Narry Kim, Amy Pasquinelli und Greg Hannon zu verdanken sind.
Bedeutung und möglicher Einsatz
Die Genregulation durch miRNAs kann man eine ähnliche große Bedeutung beimessen wie der Regulation durch Transkriptionsfaktoren. Die Grundsätze der Spezifität und Kreuzreagibilität sind gleichermaßen gegeben. Die aus der Prozessierung der pri-miRNAs hervorgehenden microRNAs binden mit unterschiedlicher Affinität an ihre Zielsequenzen - so sind sowohl hochspezifische als auch grundlegende Regulationssysteme denkbar.
Das Einbringen von RNAi in Zellen durch Transfektion hat sich als gentechnisches Verfahren zum Ausschalten von Genen in Laborversuchen etabliert. Vor allem die temporäre Verringerung der Genaktivität an Stelle des definitiven Ausschaltens bietet Möglichkeiten zur weiteren Erkenntnisgewinnung.
Es gibt intensive Forschungen an der Nutzung zur Heilung von Krankheiten im Sinne einer „negativen Gentherapie“. Dabei erhofft man sich besonders bei der Therapie von viralen, neoplastischen, degenerativen und metabolischen Erkrankungen u. a. ein wertvolles Instrument. Allerdings fanden Gitlin et al. 2002 auch eine Polio-Viren-Mutante, die der RNAi entgehen kann. Therapien, die auf RNA-Interferenz basieren, befinden sich bisher noch im Forschungs- und frühen Entwicklungsstadium.
Literatur: Übersichtsartikel
- MicroRNAs in gene regulation: When the smallest governs all. J Biomed Biotechnol 2006 art. 69616
- Structured domains in RNAi. Febs Lett. 2005;579:5841
- Identification and characterization of small RNAs involved in RNA silencing. Febs Lett. 2005;579:5830
Weblinks
Einzelnachweise
- ↑ Napoli C., Lemieux C., Jorgensen R. (1990): Introduction of a chalcone synthase gene into Petunia results in reversible co-suppression of homologous genes in trans. In: Plant Cell. Bd. 2, Nr. 4, S. 279-289. PMID 12354959 PDF
- ↑ Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S.E., Mello C.C. (1998): Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. In: Nature. Bd. 391, S. 806-811. PMID 9486653 [1]
- ↑ Hamilton, A.J. und Baulcombe, D.C. (1999): A species of small antisense RNA in posttranscriptional gene silencing in plants. In: Science. Bd. 286, Nr. 5441, S. 950-952. PMID 10542148
- ↑ Elbashir S.M., Harborth J., Lendeckel W., Yalcin A., Weber K., Tuschl T. (2001): Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. In:Nature 24;411(6836):494-8. PMID 11373684 [2]
Wikimedia Foundation.