- Stillekupplung
-
Die Stille-Kupplung ist eine Palladium-katalysierte Kupplung einer Organozinnverbindung (Organostannane) mit einem sp2-hybridisierten organischen Halogenid.[1][2] Die Reaktion ist inzwischen in der organischen Synthesechemie sehr weit verbreitet.
- R-SnR'3 + R"-X ⇌ R-R" + X-SnR'3
X ist typischerweise ein Halogenid, wie Cl, Br, I oder ein Pseudo-Halogenid wie das Triflat, CF3SO3-.[3][4]
Die Stille-Kupplung wurde 1977 von John K. Stille et. al. entdeckt. Stille-Kupplungen waren 1992 in 50% aller veröffentlichten Synthesen, die Kreuz-Kupplungs-Reaktionen enthielten, verwendet worden. Die Reaktion wird zur Zeit vor allem im Hinblick auf die Anwendung in der industriellen Synthese von Pharmazeutika weiterentwickelt.
Da Sauerstoff sowohl die Oxidation des Palladium-Katalysators verursacht, als auch eine Homokupplung der Organozinnverbindungen begünstigt, muss die Reaktion unter Inertgas-Atmosphäre und in absolutiertem Lösungsmittel durchgeführt werden.
Als Organozinn-Verbindung nutzt man in der Regel eine Trimethylstannyl- oder Tributylstannylverbindung. Obwohl die Trimethylstannylverbindung, verglichen mit der Tributylverbindung eine höhere Reaktivität zeigt, verwendet man erstere ungern, da sie eine 1000 mal höhere Toxizität zeigt. Daher verwendet man Trimethylstannylverbindungen nur, wenn es unbedingt notwendig ist.
Inhaltsverzeichnis
Reaktionsmechanismus
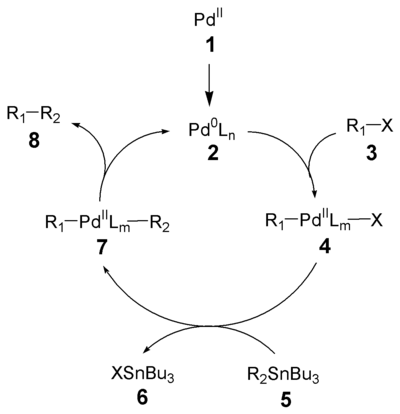
Der Reaktionsmechanismus der Stille-Kupplung ist weitgehend aufgeklärt.[8]In einem ersten Schritt erfolgt die Reduktion des Palladiumkatalysators (1) zur aktiven Pd(0)-Spezies (2). Die Oxidative Addition des Organohalogenids (3) ergibt das cis-Intermediat welches rasch zum trans-Intermediat 4 isomerisiert.[9] Transmetallierung mit dem Organostannan (5) formt das Intermediat 7, welches nach reduktiver Eliminierung das Produkt (8) ergibt und die aktive Pd(0)-Spezies (2) regeneriert. Die oxidative Addition und die reduktive Eliminierung bewahren die stereochemische Konfiguration der Reaktanten.
Rate des Ligandentransfers (Transmetallierung) des Zinns:
alkinyl > alkenyl > aryl > allyl = benzyl > α-alkoxyalkyl > alkyl
Variationen
Um die Ausbeute der Reaktion zu erhöhen setzt man der Reaktionsmischung oft Lithiumchlorid zu. Dieses stabilisiert das in der oxidativen Addition gebildete Intermediat und beschleunigt so die Reaktion.
Reaktivität und Spezifität der Stille-Kupplung kann durch die Zugabe stöchiometrischer Mengen an Kupfer(I)- oder Mn(III)-Salzen erhöht werden. [10][11][12]
In Gegenwart der Cu(I)-Salze zeigt Palladium auf Kohle (Pd/C) eine hohe katalytische Aktivität.[13]
Quellen
- ↑ Kosugi, M. et al. Chem. Letters 1977, 301.
- ↑ Milstein, D.; Stille, J. K. J. Am. Chem. Soc. 1978, 100, 3636. (doi:10.1021/ja00479a077)
- ↑ Scott, W. J.; Crisp, G. T.; Stille, J. K. Organic Syntheses, Coll. Vol. 8, p.97 (1993); Vol. 68, p.116 (1990). (Article)
- ↑ Stille, J. K.; Echavarren, A. M.; Williams, R. M.; Hendrix, J. A. Organic Syntheses, Coll. Vol. 9, p.553 (1998); Vol. 71, p.97 (1993).
- ↑ Stille, J. K. Angew. Chem. Int. Ed. Engl. 1986, 25, 508–524. (Review)
- ↑ Farina, V.; Krishnamurthy, V.; Scott, W. J. Org. React. 1998, 50, 1–652. (Review)
- ↑ Mitchell, T. N. Synthesis 1992, 803-815. (Review)
- ↑ Casado, A. L.; Espinet, P. J. Am. Chem. Soc. 1998, 120, 8978–8985. (doi:10.1021/ja9742388)
- ↑ Casado, A. L.; Espinet, P. Organometallics 1998, 17, 954–959.
- ↑ Liebeskind, L. S.; Fengl, R. W. J. Org. Chem. 1990, 55, 5359.
- ↑ Farina, V.; Kapadia, S.; Krishnan, B.; Wang, C.; Liebeskind, L. S. J. Org. Chem. 1994, 59, 5905.
- ↑ Liebeskind, L. S.; Peña-Cabrera, E. Organic Syntheses, Coll. Vol. 10, p.9 (2004); Vol. 77, p.135 (2000). (Article)
- ↑ Roth, G. P.; Farina, V.; Liebeskind, L. S.; Peña-Cabrera, E. Tetrahedron Letters 1995, 36, 2191.
14. Renaldo, A. F.; Labadie, J. W.; Stille, J. K. Organic Syntheses, Coll. Vol. 8, p.268 (1993); Vol. 67, p.86 (1989). (Article)
Siehe auch
- Heck-Reaktion
- Hiyama-Kupplung
- Suzuki-Kupplung
Weblinks
- Stille reaction handout der Myers group.
- Stille reaction auf organic-chemistry.org
Wikimedia Foundation.