- Subarachnoidal-Blutung
-
Klassifikation nach ICD-10 I60.0 Subarachnoidalblutung, vom Karotissiphon oder der Karotisbifurkation ausgehend I60.1 Subarachnoidalblutung, von der A. cerebri media ausgehend I60.2 Subarachnoidalblutung, von der A. communicans anterior ausgehend I60.3 Subarachnoidalblutung, von der A. communicans posterior ausgehend I60.4 Subarachnoidalblutung, von der A. basilaris ausgehend I60.5 Subarachnoidalblutung, von der A. vertebralis ausgehend I60.6 Subarachnoidalblutung, von sonstigen intrakraniellen Arterien ausgehend I60.7 Subarachnoidalblutung, von nicht näher bezeichneter intrakranieller Arterie ausgehend I60.8 Sonstige Subarachnoidalblutung I60.9 Subarachnoidalblutung, nicht näher bezeichnet I69.0 Folgen einer Subarachnoidalblutung ICD-10 online (WHO-Version 2006) Die Subarachnoidalblutung (von griech. ἀραχνοειδής, „die spinnenartige [Hirnhaut]“, abgeleitet; siehe Spinnenhaut) ist ein krankhaftes Geschehen im Bereich des zentralen Nervensystems von Mensch und anderen Wirbeltieren. Es ist dadurch gekennzeichnet, dass freies Blut in den mit Hirnflüssigkeit (Liquor cerebrospinalis) gefüllten Subarachnoidalraum gelangt.
Ursache für diese spezielle Form des Schlaganfalles ist in den meisten Fällen das Platzen eines arteriellen Gefäßes aufgrund einer Missbildung. Der Zustand der freien Blutung führt zu Reizungen von Blutgefäßen des Gehirns und der Hirnhäute. Eine Anstauung von Hirnflüssigkeit mit Druckerhöhung im Schädel (Hydrocephalus) ist typisch für einen komplizierten Verlauf.
Die Subarachnoidalblutung geht mit plötzlichem schwerstem Kopfschmerz und Nackensteifigkeit einher. Sie kann zu kurzzeitigen Bewusstseinsstörungen, aber auch zu schwersten dauerhaften Gehirnfunktionsstörungen führen.
Inhaltsverzeichnis
Erkrankungshäufigkeit, Prognose
Die Subarachnoidalblutung gehört zum Formenkreis der Apoplexien (Schlaganfall). Sie ist für sechs bis zehn Prozent der Schlaganfälle verantwortlich. Nach der aktuellen Studienlage kann man davon ausgehen, dass in Industrienationen etwa zehn Personen pro 100.000 Einwohner und Jahr eine Subarachnoidalblutung erleiden (Inzidenz)[1][2][3]. Dies entspricht ungefähr 10.000 neuen Patienten pro Jahr in Deutschland. Weltweit schwankt die Inzidenz ziemlich stark zwischen 2 (China) und 22 (Finnland) Personen pro 100.000 Einwohner und Jahr.[4]
40 Prozent der Erkrankten versterben innerhalb der ersten 30 Tage nach dem Ereignis.[4] Von den Überlebenden bleiben 25 bis 50 Prozent schwer behindert.[5] Die Sterblichkeit bei Rezidivblutungen (siehe Abschnitt „klinisches Bild und Schweregradeinteilung“) beträgt 50 bis 70 Prozent.[6]
Definition
Anatomische Grundlagen
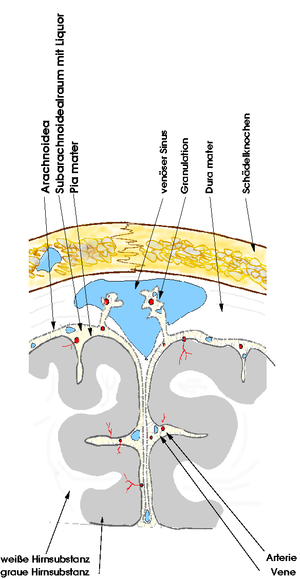
Der Subarachnoidalraum (Cavum subarachnoidale) umgibt Gehirn und Rückenmark wie ein flüssigkeitsgefülltes Kissen, in dem das Gehirn regelrecht in der Gehirnflüssigkeit, dem Liquor cerebrospinalis, schwimmt. Das Gehirn ist damit so gelagert, dass es weitgehend vor Schäden durch Erschütterungen geschützt ist.
Die Wände des Subarachnoidalraumes bilden außen die Spinnenhaut (lat.: Arachnoidea) und innen die weiche Hirnhaut (Pia mater).
Die Arachnoidea liegt der harten Hirnhaut (Dura mater) innen an. Sie spannt sich über die Oberfläche des Gehirns, zieht aber, mit Ausnahme des Interhemisphärenspalts (Fissura longitudinalis cerebri), nicht in die einzelnen Hirnfurchen (Sulci) hinein. Von der Arachnoidea aus stülpen sich kleine gefäßreiche Aussackungen (Granulationes arachnoideae, Pacchioni-Granulationen) in die mit venösem Blut gefüllten Sinus der harten Hirnhaut. Sie dienen der Regulation der Liquormenge und nehmen überschüssigen Liquor auf. Die Arachnoidea ist mit feinen Fäden mit der Pia mater verbunden.
Die Pia mater liegt unmittelbar der Gehirnoberfläche auf und folgt ihr in alle Furchen.
Der Subarachnoidalraum umgibt Gehirn und Rückenmark und beherbergt die versorgenden Blutgefäße (Arterien und Venen). Es handelt sich um einen schmalen Spaltraum, der an einigen Stellen (zum Beispiel im Bereich der Hirnbasis) zu Zisternen erweitert ist. In den Erweiterungen des Subarachnoidalraums und im Interhemisphärenspalt sammelt sich das Blut häufig und ist dann mit bildgebenden Verfahren (Computertomografie) an typischen Mustern erkennbar.
Ursache und Verlauf der Blutung
Eine Blutung im sonst gesunden Gehirn entsteht in der Regel an besonderen Schwachstellen des Gefäßsystems. Das sind vor allem Aneurysmata. Es handelt sich dabei um sackförmige Aufweitungen arterieller Gefäßwände, die zu einer Wandverdünnung im betroffenen Bereich führen.
Zumeist sind Aneurysmata angeboren. Sie treten dann vorwiegend an Orten erhöhter Belastung durch den Blutstrom auf. Insbesondere Gabelungsstellen von Arterien sind aufgrund von Wirbelbildungen und ähnlichen hämodynamischen Faktoren gefährdet. Betroffen sind dann vor allem Gefäßabschnitte, die durch Arteriosklerose oder entzündliche Arterienkrankheiten verändert sind. Deutlich seltener können Aneurysmata auch im Laufe des Lebens erworben werden. Ein gehäuftes Auftreten findet man bei fibromuskulärer Dysplasie, polyzystischer Nierenerkrankung sowie bei Bindegewebserkrankungen wie dem Marfansyndrom.
Im Falle einer Subarachnoidalblutung hält dieser dünne Wandabschnitt der Belastung eines sonst durchaus tolerierten Blutdruckanstieges nicht mehr stand und das Gefäß platzt an dieser Stelle.
Hauptsächlich sind Gefäße betroffen, die den Circulus arteriosus cerebri (Willis) bilden. Dieses Gefäßsystem an der Gehirnbasis verbindet die größten hirnversorgenden Arterien miteinander.
Rupturen (Einrisse) von Aneurysmata der Hirnbasis sind bei 80 % der Erkrankungen Ursache der Subarachnoidalblutung; außerdem kommen Angiome (gutartige Gefäßmissbildungen) und arteriovenöse Fehlbildungen vor. In 5-10 % aller Fälle kann keine Blutungsquelle gefunden werden.[6]
Die Blutungen treten gewöhnlich nach Situationen mit kurzzeitiger Blutdruckerhöhung auf, etwa Defäkation (Absetzen des Stuhles), körperliche Anstrengung, Heben schwerer Lasten oder Geschlechtsverkehr. Allerdings können Aneurysmarupturen auch in völliger Ruhe und spontan geschehen. Subarachnoidalblutungen treten gehäuft im höheren Lebensalter und bei Schwangerschaften auf. Als erwiesene Risikofaktoren für eine Ruptur sind ein erhöhter Blutdruck sowie das Rauchen anerkannt.
Im Unterschied zur Erstblutung, die nur anhand ihrer Ergebnisse bekannt wird, sind wiederkehrende Blutungen einer ursächlichen Therapie zugänglich. Die Vermeidung dieser Rezidivblutungen ist das Ziel der schnellen Diagnostik und operativen Therapie.
In einigen Fällen führen Unfälle (Schädel-Hirn-Traumen) zu einer Subarachnoidalblutung. Dabei ist aber derzeit nicht mit Sicherheit zu sagen, ob die Ursache der Blutung nicht auch hier im Einreißen einer Missbildung (zum Beispiel Aneurysma) liegt.
Komplikationen
Die gefürchteten Folgen einer Subarachnoidalblutung sind:
- wiederholte Blutung (so genannte Rezidivblutung)
- lokale Gefäßverengungen (Vasospasmus)
- Hydrocephalus
- Hyponatriämie
- epileptische Anfälle
Rezidivblutung
Die meisten schweren Subarachnoidalblutungen beruhen auf Mehrfachereignissen. Starken Blutungen gehen meist kleinere voraus; jeder Blutung können weitere folgen. Die Ursache für diese Rezidivblutungen liegt in der Tatsache begründet, dass die Gefäßmissbildung, die zu der vorhergehenden Blutung geführt hat, weiter existiert, sofern keine entsprechende Therapie durchgeführt wurde. Etwa 35 % der Nachblutungen treten in den ersten drei Stunden auf, bis zu 49 % innerhalb der ersten sechs Stunden. 60 % der Patienten, die eine Nachblutung erlitten starben in den ersten drei Monaten. Am häufigsten treten Nachblutungen innerhalb der ersten drei Tage nach dem Initialereignis auf. Ihre Häufigkeit liegt bei optimaler medizinischer Versorgung bei rund 7 %.[7]
Vasospasmus
Die Subarachnoidalblutung führt zu einer Reizung von Blutgefäßen. Das Resultat ist eine aktive Verengung (Gefäß- oder Vasospasmus) der betroffenen Gefäße (vor allem vermittelt durch lokal sezernierte vasoaktive Substanzen wie Serotonin oder Prostaglandin). Damit kommt es zu einer Minderversorgung des Hirngewebes mit Sauerstoff. Die Folge kann einerseits ein ischämischer Schlaganfall sein, der in Abhängigkeit von Dauer und Größe des betroffenen Bereiches zu bleibenden Hirnfunktionsschädigungen führt. Auf der anderen Seite führen später einsetzende, generalisierte Vasospasmen zur Mangelversorgung des gesamten Gehirns.
Der Vasospasmus ist die bestimmende Einflussgröße auf das Behandlungsergebnis. Er tritt mit einer Häufigkeit von 40 bis 60 Prozent bei Subarachnoidalblutungen auf. 1/3 der Spasmen wird erst an seinen Folgen sichtbar (DIND = delayed ischemic neurological deficit).[5] Der Früherkennung dieser Zustände dient die transkranielle Dopplersonografie (siehe unten). Vasospasmen treten in der Regel innerhalb von 4 bis 14 Tagen nach dem Initialereignis auf.
Die Ursache des Vasospasmus ist bisher nicht eindeutig geklärt. Zum einen wird er auf die Wirkung von Substanzen zurückgeführt, die beim Zerfall der roten Blutkörperchen (Erythrozyten) freiwerden. Diese Substanzen sollen gefäßverengend (vasokonstriktorisch) auf gesunde Gefäße wirken (Endotheline, Prostaglandine). Es ist aber auch eine Wirkung im Sinne der Blockade gefäßerweiternder (vasodilatierender) Stoffe (Substanz P) vorstellbar. Eine wichtige Rolle spielt das freiwerdende Hämoglobin, das das zur Aufrechterhaltung des normalen Gefäßkalibers notwendige NO bindet. Diese Eigenschaft wird als NO-scavenging bezeichnet. Der resultierende NO-Mangel trägt zur Verengung der Arterien bei. Zum anderen werden auch örtliche Entzündungsreaktionen verantwortlich gemacht, wofür die Aktivierung des Komplementsystems spricht.
Wenn das Blut auch die Pia mater (weiche Hirnhaut) durchdringt (etwa durch einen Einriss), dann entsteht zusätzlich eine Einblutung in das Hirngewebe (so genannte parenchymatöse Einblutung). Der Krankheitsverlauf wird dadurch noch komplizierter, ein Dauerschaden wahrscheinlicher und größer.
Hydrocephalus
Durch die Funktionsstörung der Pacchioni-Granulationen (Granulationes arachnoideae), den Verschluss des Aquaeductus und der Austrittsstellen des IV. Ventrikels kann es zur Anstauung der Hirnflüssigkeit (Hydrocephalus, „Wasserkopf“) kommen. Da der Liquor aber dauernd nachgebildet wird, kommt es einerseits zu einem Missverhältnis zwischen dem Raumbedarf von Hirnmasse, normalem Blutvolumen und Hirnflüssigkeit und andererseits dem Raumangebot des knöchernen Schädels. Dadurch steigt der Druck in der Schädelhöhle, was zu komplexen Hirnschäden (zum Beispiel durch Einklemmungen von Hirnteilen an den Falten [falx] der Dura mater) führen kann. Je nach Ursache unterscheidet man einen aresorptiven (Pacchioni-Granulationen) und occlusiven (Aquaeductus, Austrittsstellen des IV. Ventrikels) Hydrocephalus.[6]
Der Hydrocephalus entsteht manchmal sofort nach subarachnoidaler Einblutung, manchmal aber auch Tage später. Er ist im Computertomogramm (CT) sehr gut darstellbar. Da ein Hydrocephalus sehr gefährlich ist, muss bei dieser Verdachtsdiagnose sofort ein CT angefertigt werden. Ein Hydrocephalus entwickelt sich innerhalb der ersten 3 Wochen nach dem Initialereignis.
Hyponatriämie
Bei 30 % der Patienten kommt es über eine erhöhte Natriumausscheidung zu einem Natriummangel im Blut (Hyponatriämie). Die Ursache ist wahrscheinlich die mechanische Irritation des Hypothalamus mit der Folge erhöhter Sekretion von antidiuretischem Hormon (SiADH). Bei Werten unter 125 mmol/l Serum treten reversible neurologische Symptome auf. Antidiuretisches Hormon führt zur Na+ Sekretion und H2O Rückresorption in der Niere und somit zu einer Verdünnungshyponatriämie.
Das Problem liegt in der Behandlung der Hyponatriämie. Ein zu rascher Ausgleich der Natriumwerte kann zur zentralen pontinen Myelinolyse mit Verlust von Nervengewebe im Bereich von Hirnstammstrukturen führen. Größte Gefahr für die Entwicklung einer Hyponatriämie besteht zwischen dem 4. und 14. Tag nach Initialereignis.
Klinisches Bild und Schweregradeinteilung
Die drei Leitsymptome der Subarachnoidalblutung sind:
- plötzlich einsetzender vernichtender Kopfschmerz (sog. „Donnerschlag-Kopfschmerz“)
- gefolgt von kurzer oder länger anhaltender Bewusstseinsstörung bis Bewusstlosigkeit (50 % der Fälle)
- Nackensteifigkeit (Meningismus)
Das Gehirn an sich ist nicht schmerzempfindlich, dafür die Arterien und die Hirnhäute. Der typische plötzliche, als vernichtend empfundene Kopfschmerz lässt sich durch die Ruptur des Gefäßes und die Reizung der benachbarten Gefäße sowie der Hirnhäute erklären.
Der Schmerz kann sich auch an anderen Stellen manifestieren. So zeigt er sich in seltenen Fällen im Bereich der Brust, der Wirbelsäule oder auch der Beine. Wahrscheinlich ist dafür die Ausbreitung des Blutes im Subarachnoidalraum verantwortlich.
Die Bewusstseinsstörungen und die Bewusstlosigkeit sind dagegen eher unspezifische Reaktionen des Gehirns auf den Stimulus. Ausfallserscheinungen von Hirnnerven oder fokale (auf eine bestimmte Region des Gehirns bezogene) epileptische Anfälle sind in der akuten Situation selten. Solche Varianten sind aber Auslöser gelegentlicher Fehldiagnosen.
Der Meningismus, als drittes Leitsymptom, ist Ausdruck der Reizung der Hirnhäute. Dabei reagiert die Dura mater des Halsbereiches schmerzhaft auf Dehnung, was durch passive Neigung des Kopfes geprüft werden kann. Bei schweren Verläufen kommt es zu einer spontanen Kopfüberstreckung nackenwärts und Hohlrückenbildung (Opisthotonus).
Eine Sehverschlechterung wird beim Terson-Syndrom beobachtet, eine Glaskörpereinblutung, die 10 bis 20 Prozent der Patienten betrifft.
Bei einer Subarachnoidalblutung treten auch gehäuft Herzsymptome auf. EKG-Veränderungen sowie Herzrhythmusstörungen sind vielfach neurogen verursacht, d. h. dass die Schädigung des Gehirns eine fehlerhafte Regulation der Herzaktion bewirkt. Überdurchschnittlich häufig werden auch Einblutungen in den Herzmuskel sowie Herzinfarkte gefunden. Vermutet wird dabei eine Funktionsstörung des Hypothalamus, einem wichtigen Regulationszentrum im Gehirn. Diese Änderungen führen zu einer vermehrten Ausschüttung von Katecholaminen, was eine Verengung von Gefäßen bewirkt. Im Herzmuskel kommt es dadurch zu einer Minderversorgung mit Sauerstoff und den genannten Folgen.[8]
Warnblutung
Bei ungefähr 25 Prozent der Patienten mit einer schweren Subarachnoidalblutung können auch Warnblutungen nachgewiesen werden. Die betroffenen Patienten berichten üblicherweise von plötzlich auftretenden, äußerst starken Kopfschmerzen („wie noch nie“), die vielfach auch angstauslösend sein können. Nach kurzer Zeit gehen sie in einen andauernden Kopf- oder Nackenschmerz über, der in der Regel nicht weiter bedrohlich empfunden wird. Die Schmerzen werden von einer gering ausgeprägten Nackensteifigkeit begleitet. Diese Art von Warnblutung entspricht dem Grad I nach Hunt und Hess (siehe Tabelle unten).
Das Problem dieser Warnblutungen besteht in erster Linie im richtigen Erkennen. Vielfach werden die Beschwerden von Patienten, aber auch von Ärzten als Migräne, außerordentliche psychische Belastung oder gar als Wirbelsäulenschmerz fehlgedeutet und auch falsch behandelt. Innerhalb von 14 Tagen folgt meistens eine deutlich schwerere Rezidiv-Subarachnoidalblutung.
Frühzeitig und richtig erkannt, könnte in vielen Fällen den Patienten rechtzeitig und effizienter geholfen werden.
Schweregradeinteilung
Klinische Schweregradeinteilung nach WFNS (World Federation of Neurological Surgeons), HUNT und HESS in Relation mit Glasgow Coma Scale Grade von WFNS oder HUNT und HESS entspricht Glasgow Coma Scale I leichter Kopfschmerz und/oder Meningismus (Nackensteifigkeit), keine neurologischen Ausfälle 15 II mäßiger bis schwerer Kopfschmerz/Meningismus, keine neurologischen Ausfälle außer Hirnnervenstörungen (hier in Kombination!), keine Bewusstseinsveränderungen 13–14 III Somnolenz oder Verwirrtheit und/oder neurologische Ausfälle 13–14 IV Sopor, schwere neurologische Ausfälle, vegetative Störungen 7–12 V Koma (Bewusstlosigkeit), Strecksynergismen, moribunder Patient 3–6 Die Schweregradeinteilung der Subarachnoidalblutung erfolgt gemäß der Einteilung der WFNS (World Federation of Neurological Surgeons) oder nach HUNT und HESS (siehe Tabelle), die gut mit dem weiteren Krankheitsverlauf korreliert.
Bei der Glasgow Coma Scale handelt es sich um eine Schweregradeinteilung bei Schädel-Hirn-Verletzungen. Es ist vorteilhaft, beide Schweregradeinteilungen gegenüberzustellen, da die Glasgow Coma Scale im Gegensatz zur WFNS im Notdienst sehr häufig angewendet und die Korrelation dadurch offensichtlich wird.
Entscheidend für die Schwere einer Subarachnoidalblutung ist die Dauer der Bewusstlosigkeit. In den meisten Fällen erwachen die Patienten nach kürzerer Zeit. 15 bis 20 Prozent der Patienten verbleiben jedoch im Koma.
Diagnostik
Grundlage der Diagnostik ist wie bei jeder anderen Erkrankung die Beurteilung des klinischen Bildes einschließlich der Schweregradeinschätzung.
Als technische Hilfsmittel haben sich die bildgebenden Verfahren
bewährt.
Außerdem sind die
- Sonografie (als transkranielles Dopplerverfahren) und die
- Lumbalpunktion
etabliert. Die beiden zuletzt genannten Methoden liefern Funktionsbeschreibungen.
Computertomografie
Die Computertomografie (CT) des Kopfes (cCT) ist die derzeit schnellste Methode zur Diagnose einer Subarachnoidalblutung. Sie hat die höchste Sensitivität (100 Prozent am ersten Tag der Blutung[9]) und Spezifität aller bildgebenden Verfahren und ist unter modernen Bedingungen – unter Verwendung eines Spiral-CT mit geringen Belastungen – für den Patienten schnell und sicher durchführbar. In 70 Prozent der Fälle lässt sich schon in einer ersten Aufnahme die Blutungsquelle vermuten. CT-Untersuchungen sollten sofort erfolgen. Bei derartigem Vorgehen wird rasches therapeutisches Handeln ermöglicht, da eine Nachblutung lebensgefährlich wäre und deshalb vermieden werden muss. Die Einteilung nach Fisher erlaubt eine Klassifikation der computertomografischen Morphologie:
- Grad 1: Kein Hinweis auf Blutung
- Grad 2: Subarachnoidalblutung von weniger als 1 mm Breite
- Grad 3: Subarachnoidalblutung von mehr als 1 mm Breite, jedoch ohne Ventrikeleinbruch
- Grad 4: Subarachnoidalblutung jeder Breite mit Ventrikeleinbruch (IVH) oder Ausdehnung ins Gehirnparenchym
Computertomografie: massive Subarachnoidalblutung bei rupturiertem großen Basilarisaneurysma Das computertomografische Bild stellt einen Schnitt durch den Schädel in Höhe einer Hutkrempe dar. Der Schnitt durch den Schädel ist also nahe der Schädelbasis. Man stelle sich den Patienten auf dem Rücken liegend mit den Füßen zum Betrachter vor. Das heißt, dass im oberen Bild die Vorderseite des Schädels dargestellt ist und die rechte und linke Seite vertauscht sind. So befindet sich etwa die Struktur mit der Ziffer 2 in der rechten Hirnhemisphäre des Patienten.
Der in weiß dargestellte Schädelknochen umrahmt das Gehirn mit seinen Gefäßen. Vorn ist schwarz die Stirnhöhle (Sinus frontalis) dargestellt.
Das Aneurysma (1) ist in diesem Fall sehr groß. Das Blut des geplatzten Aneurysmas hat sich in den umgebenden Zisternen ausgebreitet (2=Cisterna valleculae cerebri, die sich aber auf der linken Seite (3) weitgehend frei darstellt).
Das Blut hat sich im schmalen Subarachnoidalraum weit verteilt. Zeichen für den erheblichen Befund sind die Blutnachweise im Interhemisphärenspalt (4) und auf einzelnen Hirnwindungen (Gyri) (6) der rechten Hirnhälfte (rechte Hemisphäre, Frontalhirn). Außerdem ist eine Einblutung in die IV. Hirnkammer (Ventrikel) dargestellt (5).
Die Seitenventrikel (7) sind frei von Blut.
Angiografie
Die zerebrale Angiografie wird als Standardmethode geführt; sie ist ein an Kontrastmittel gebundenes Verfahren der Gefäßdarstellung unter Einsatz von Röntgenstrahlung. Bei hoher Sensitivität muss sie aber in den ersten Stunden durchgeführt werden, da anschließend das Aneurysma als Blutungsquelle verschlossen werden muss, um einen therapeutischen Nutzen zu erlangen. Diese seit langem ausgereifte Methode gilt in ihrer Sonderform, der digitalen Subtraktionsangiografie, den virtuellen Gefäßdarstellungsverfahren von Computertomografie und Kernspin in der diagnostischen Aussagekraft derzeit noch überlegen. Letztere sind jedoch meist schneller erhältlich und für den Patienten weniger belastend.
Angiografie: massive Subarachnoidalblutung bei rupturiertem großen Basilarisaneurysma Im dargestellten digitalen Subtraktionsangiogramm handelt es sich um den gleichen Fall, wie in der Computertomografie oben. Das Aneurysma (1) befindet sich im Bereich der Arteria basilaris (2). Dieses Hirngefäß entspringt aus den Arteriae vertebrales (3), wobei über eine das Kontrastmittel injiziert wurde. Die Arteria basilaris spaltet sich in ihrem weiteren Verlauf in die beiden Arteriae cerebri posteriores (4), die im vorliegenden Fall unauffällig sind.
Sonografie
Dem Ziel der Einschätzung des Vasospasmus dient die transkranielle Dopplersonografie. Die Methode ist als Ultraschallverfahren so gut wie frei von Nebenwirkungen. Sie soll in den ersten zehn Tagen nach der akuten Blutung täglich zum Einsatz kommen, um auch Vasospasmen zu erkennen, die anfänglich symptomfrei verlaufen (DIND – siehe oben).[6]
Im Dopplerverfahren wird anhand der Reflexion an den sich bewegenden Blutzellen die Fließgeschwindigkeit des Blutes ermittelt. Während Fließgeschwindigkeiten unter 100 cm/s als normal gelten, werden Werte über 160 cm/s als kritisch eingeschätzt.
Lumbalpunktion
Die klassische Lumbalpunktion mit Entnahme von Liquor ist hoch sensitiv. Schon nach Minuten ist bei einer Subarachnoidalblutung im Gehirn Blut im Liquor im Bereich der Lendenwirbelsäule nachweisbar. Dieser Befund beweist die Subarachnoidalblutung rein qualitativ, die Lokalisation der Blutung ist damit nicht ermittelbar.
Bei dieser invasiven Methode besteht das Risiko, dass durch die Manipulation (Leck in der lumbalen Dura mater) und deren Folgen unkontrolliert Liquor verloren geht. In der Folge kann es zu einem Unterdruck in den Hirnkammern kommen. Dieses Druckverlustsyndrom ist mit weiteren Schädigungsmöglichkeiten des Gehirns verbunden. Eine Lumbalpunktion sollte deshalb nur dann erfolgen, wenn das Computertomogramm kein Ergebnis bringt, die Symptome des Patienten aber eindeutig auf eine Subarachnoidalblutung hinweisen.
Zu beachten ist weiterhin, dass während der Lumbalpunktion selbst kleine Blutungen auftreten können, die aber unwesentlich sind. Sie können jedoch den Liquor blutig verfärben und eine Subarachnoidalblutung vortäuschen. Die roten Blutkörperchen (Erythrozyten) zerfallen im Liquor und geben damit das sonst an sie gebundene Hämoglobin frei. Dieser Vorgang ist abhängig von der abgelaufenen Zeit. Erythrozyten, die im Falle einer Subarachnoidalblutung im Schädel freigesetzt werden sind im Liquor des Lumbalbereiches nicht mehr nachweisbar, dafür aber ihre Farbstoffe. Um Blut aus einem geplatzten Hirngefäß von frischem Blut (bei der Punktion entstanden) zu unterscheiden, muss der blutige Liquor zentrifugiert werden, um alle zellulären Bestandteile entfernen zu können. Sollte der Liquor danach noch eine Verfärbung aufweisen (sog. xanthochromer Überstand) wäre die Diagnose bestätigt.
Therapie
Erste Hilfe
Im Folgenden werden nur Therapierichtlinien beschrieben, die in ihrer wissenschaftlichen Ausgereiftheit den Kriterien der evidenzbasierten Medizin genügen oder in die Leitlinien der medizinisch-wissenschaftlichen Gesellschaften aufgenommen wurden. Damit handelt es sich um diejenigen Methoden, die das Überleben und das Outcome eines betroffenen Patienten nachweisbar und wirkungsvoll verbessern. Sie stellen den gegenwärtigen Stand der medizinischen Handlungsroutine dar.
Die Subarachnoidalblutung erfordert meistens Beobachtungs- und Behandlungsmethoden der Intensivmedizin.
Primär folgt die Therapie den unspezifischen Zielen der Stabilisierung des Allgemeinzustandes. Von Seiten der Atmung muss eine Hyperkapnie (CO2-Erhöhung im Blut durch unzureichende Atmung) vermieden werden, da sie zur Hirndruckerhöhung führen kann. Deshalb wird die Entscheidung für eine Beatmung großzügig getroffen.
Zielgerichtete Verfahren verfolgen die Ziele:
- Vermeidung einer Rezidivblutung
- Behandlung des Hydrocephalus
- Vorbeugung und Behandlung des Vasospasmus
Vermeidung einer Rezidivblutung
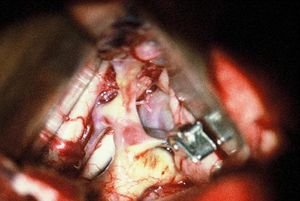
Die chirurgische Therapie ist mit hoher Evidenz zur Prophylaxe von Rezidivblutungen geeignet.[6] Es haben sich das Clipping und das Coiling bewährt:
- Clipping (Verschluss durch eine Klemme) des Aneurysmas als neurochirurgischer Eingriff, um ein Nachbluten zu unterbinden
- Coiling des Aneurysmas als interventionelle radiologische Methode über einen intravasalen Katheter. Beim Coiling wird eine feine Platinspirale in den Aneurysmasack eingeführt. Damit werden Gerinnungsvorgänge initiiert, die über die Fibrinisierung und bindegewebige Umwandlung zu einer Verödung des Aneurysmas führen.
OP-Befund bei Clipping Beide Methoden, Clipping oder Coiling, erfolgen für gewöhnlich in den ersten 72 Stunden nach Blutung oder erst 10 Tage später, da die Gefäße in der Zwischenzeit besonders empfindlich reagieren und die Entwicklung von Gefäßspasmen wahrscheinlich ist.
Das Coiling bietet den Vorteil, dass man für den Patienten schonender zu den betroffenen Gefäßstellen vordringen kann, ohne dass, abhängig von der Lage des Aneurysmas, der Schädel eröffnet und Hirngewebe verletzt oder entfernt werden muss. Es ist auch zur Prophylaxe von asymptomatischen Aneurysmen geeignet.
Vorbeugung und Behandlung des Vasospasmus
Neben grundsätzlichen intensivmedizinischen Behandlungsrichtlinien, wie positive Flüssigkeitsbilanz, Hypervolämie, Vermeidung hypotensiver Blutdruckwerte und niedriger Natriumwerte, hat sich der Einsatz des Calcium-Antagonisten Nimodipin als höchst evident erwiesen.
Calcium-Antagonisten relaxieren präkapilläre Sphinkteren, also muskelstarke Teile von arteriellen Gefäßen. Sie wirken damit dem Vasospasmus bei der Subarachnoidalblutung entgegen. Der Calcium-Antagonist Nimodipin reichert sich durch seine besonders hohe Fettlöslichkeit stark im Gehirn an und ist deshalb zur Behandlung der Subarachnoidalblutung geeignet. Dadurch, dass beim Vasospasmus die Durchblutung am Wirkort des Medikamentes gestört ist, kann Nimodipin seine Wirkung im Prinzip aber nur im Sinne der Vorbeugung der Gefäßverengung entfalten.
Nimodipin sollte sowohl in leichten Fällen (HUNT und HESS I) als auch bei den schweren Verläufen gegeben werden. Nachteilig ist seine blutdrucksenkende Wirkung, besonders bei intravenöser Applikation. Sollte diese Nebenwirkung nicht beherrschbar sein, dann kann zu Gunsten eines ausreichenden Blutdruckwertes auf Nimodipin verzichtet werden[6].
Bemerkung: Nimodipin steht in der letzten Zeit in der Kritik. Gründe sind:
- Die erweiternde Wirkung des Medikamentes im Bereich der Hirngefäße kann nicht direkt nachgewiesen werden.
- Im Bereich der Lungengefäße kommt es zu Shuntbildungen. Diese Kurzschlüsse des funktionalen Kreislaufes verschlechtern die Lungenfunktion.
- Die Blutdrucksenkung ist hoch ausgeprägt. Das widerspricht den Prinzipien der unten aufgeführten 3H-Therapie, der der Vorzug gegeben wird.
Nimodipin wird anhand von Überlebensraten-Analysen derzeit allein eine neuroprotektive Wirkung zugeschrieben, was der Grund für die Einschätzung der hohen Evidenz bei der Behandlung der Subarachnoidalblutung ist. Die Nachteile von Nimodipin werden als zu schwerwiegend eingeschätzt, so dass es in mehreren Zentren nicht mehr angewendet wird.
Methode und Ziel der 3H-Therapie [6] Hydroxyäthylstärke (HAES 130 10 % 500–1000 ml/die) und kristalloide Lösung 3000–10000ml/Tag (!) Hämodiltution (Blutverdünnung) und Hypervolamie (Erhöhung des Blutvolumens) um die Viskosität des Blutes zu senken. Das dünnflüssigere Blut soll die „Engstelle“ im Bereich der Vasokonstriktion besser überwinden können. inotrope Substanzen (Dopaminhydrochlorid 3–30 µg/kg/min oder Noradrenalin) Hypertonie um den inneren Druck der Gefäße (Perfusionsdruck) zu erhöhen, mit dem Ziel, die „Engstelle“ von innen aufzudrücken, damit Blut in die kapillären Gefäßbereiche gelangen kann. Es werden systolische (obere) Blutdruckwerte von bis zu 240 mmHg bei geclipptem Aneurysma angestrebt. Zur Behandlung des Vasospasmus ist mit guter Evidenz die 3H-Therapie (hypertensive hypervolämische Hämodilution, Triple-H-Therapie) geeignet:
- Hypervolämie
- Hypertonie
- Hämodilution
Die 3H-Therapie verfolgt das Ziel, die gestörte Durchblutung des geschädigten Hirngewebes mittels eines hohen inneren Gefäßdurchsatzes zu verbessern. Dazu wird der Fluss (Hypervolämie) sowie der innere Druck der Gefäße erhöht (Hypertonie) und die Viskosität (Zähigkeit) des Blutes durch Verminderung des Erythrozytenvolumens („Blutverdünnung“ (Hämodilution)) erniedrigt. Das Verfahren erfordert strengste Überwachung um eine Überwässerung des Organismus mit Auswirkungen auf Gasaustausch (Atmung, Lungenfunktion) und Kreislaufsystem in vertretbaren Grenzen zu halten.
In besonderen Fällen bietet sich die transluminale Ballon-Angioplastie an. Dabei handelt es sich um eine invasive Methode, bei der das Gefäß von innen über Kathetertechnik aufgeweitet wird. Da die Gefäße für den Katheter gut zugänglich sein müssen, eignet sich die Methode nur in wenigen Fällen (distale Arteria carotis interna, Arteria vertebralis und Arteria basilaris). Die transluminale Ballon-Angioplastie, die auch bei der koronaren Herzerkrankung Verwendung findet, wird im Falle der Subarachnoidalblutung nur in wenigen spezialisierten Zentren ausgeführt.
Neuere innovative Ansätze verfolgen eine Vasospasmusprophylaxe durch sogenanntes 'Clot-Removal'. Hierbei werden Spülverfahren angewandt um das Blut, als wesentlichen auslösenden Faktor des Vasospasmus, frühzeitig auszuwaschen.
Behandlung des Hydrocephalus
Außer regelrechter intensivmedizinischer Versorgung mit Sicherung des Gasaustausches (Beatmung) bleibt die Anlage eines Ventrikelkatheters Methode der Wahl. Mit dem Katheter wird überschüssiger Liquor aus dem Ventrikelsystem (Gehirnkammern) nach außen abgeleitet.
30 % der Patienten leiden auch später unter Hydrocephalus. In diesen Fällen kann der Liquor über einen dauerhaft implantierten Katheter zum Beispiel in das Bauchfell abgeleitet werden.
Quellenangaben
- ↑ Wood M.J., Nowitzke A.M.: Epidemiological aspects of spontaneous subarachnoid haemorrhage in Queensland, Australia. J Clin Neurosci. (2005) 12(7):770-4
- ↑ Pobereskin L.H.: Incidence and outcome of subarachnoid haemorrhage: a retrospective population based study. J Neurol Neurosurg Psychiatry. (2001) 70(3):340-3
- ↑ Nielsson O.G. et al.: Incidence of intracerebral and subarachnoid haemorrhage in southern Sweden. J Neurol Neurosurg Psychiatry. (2000) 69(5):601-7
- ↑ a b Ingall T. et al.: A multinational comparison of subarachnoid hemorrhage epidemiology in the WHO MONICA stroke study. Stroke. (2000) 31(5):1054-61
- ↑ a b H. H. Steiner und G. Ranaie: Die akute Subarachnoidalblutung. In: Eckart, Forst, Burchardi (Hrg.): Intensivmedizin. ecomed, 2004, ISBN 3-609-20177-0
- ↑ a b c d e f g Leitlinie Subarachnoidalblutung der Deutschen Gesellschaft für Neurologie bei AWMF online (Stand 10/2005)
- ↑ Naidech A.M. et al.: Predictors and impact of aneurysm rebleeding after subarachnoid hemorrhage. Arch Neurol. (2005) 62(3):410-6
- ↑ D. S. Pine, L. Tierney Jr.: A stressful interaction. N Engl J Med (1996) 334:1530-1534 PMID 8618610 (Herzveränderungen bei Subarachnoidalblutung)
- ↑ Timo Krings u. a.: Bildgebende Diagnostik bei der Abklärung des Kopfschmerzes. In: Deutsches Ärzteblatt 45/2004, S. 3026 ff.
Literatur
- Klaus Poeck, Werner Hacke: Neurologie. 11. Auflage. Springer, Berlin 2001. ISBN 3-540-41345-6
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.