- Symproportionierung
-
Eine Komproportionierung - auch Synproportionierung genannt - ist das Gegenteil der Disproportionierung. Beides sind Spezialfälle einer Redoxreaktion. Bei der Komproportionierung wird durch gleichzeitige Reduktion und Oxidation aus einer höheren und einer niedrigeren Oxidationsstufe zweier Atome des gleichen Elementes eine mittlere Oxidationsstufe gebildet.
Beispiel
Ein Beispiel ist die Reaktion der Iodatometrie bei der in saurer Lösung Iodat reduziert und gleichzeitig Iodid oxidiert wird. Im Produkt liegt Iod in der Oxidationsstufe 0 vor. Die römischen Ziffern oberhalb der Reaktionsgleichung geben die formalen Oxidationszahlen an.
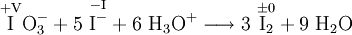
- Iodat und Iodid reagiert in saurer Lösung zu Iod und Wasser.
Wikimedia Foundation.
