- Tamiflu
-
Strukturformel 
Allgemeines Freiname Oseltamivir Andere Namen (3R,4R,5S)-4-Acetamido-5-amino-3- (1-ethylpropoxy)cyclohex-1-en- 1-carbonsäureethylester
Summenformel C16H28N2O4 CAS-Nummer 196618-13-0 PubChem 65028 ATC-Code J05AH02
DrugBank APRD01148 Arzneistoffangaben Wirkstoffklasse Fertigpräparate Tamiflu® (D)
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 312,40 g·mol−1 Sicherheitshinweise Gefahrstoffkennzeichnung
unbekanntR- und S-Sätze R: ? S: ? Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Oseltamivir ist ein Arzneistoff aus der Gruppe der Neuraminidase-Hemmer, der für die Therapie der Virusgrippe (Influenza) bei Kindern ab einem Jahr und Erwachsenen mit influenzatypischen Symptomen, sowie zur Postexpositionsprophylaxe (Vorbeugung nach möglichem Kontakt mit einem Infizierten) bei Kindern ab einem Jahr und Erwachsenen zugelassen ist. Oseltamivir ist neben Zanamivir und Amantadin zurzeit ein wirksames Mittel gegen die echte, durch Influenza-A- oder Influenza-B-Viren ausgelöste humane Virusgrippe. Oseltamivir wird von der Firma Roche unter dem Markennamen Tamiflu® angeboten und unterliegt der ärztlichen Verschreibungspflicht. Die Wirksamkeit von Oseltamivir gegen die Vogelgrippe konnte bisher nur in Bezug auf eine Linderung der Symptome belegt werden, da es die Vermehrung der Viren im Körper zwar behindert, die Viren aber nicht abtötet (eliminiert); es wirkt virostatisch, also nicht viruzid.
Inhaltsverzeichnis
Geschichte
Die Entwicklung eines wirksamen Grippemittels begann in den frühen 1990er Jahren. Wissenschaftler des Parkville Campus für Pharmazie an der Monash University im australischen Melbourne präsentierten am 14. Oktober 1992 auf einem Infektiologiekongress in Los Angeles einen Vorläufer von Zanamivir ohne Arzneimittelzulassung als ein wirksames Mittel gegen Grippe an Mäusen. Dieser Wirkstoff musste jedoch über die Lunge inhaliert werden, wo die Krankheit auch meist ausbricht. Norbert Bischofberger von der Biotechnologie-Firma Gilead Sciences in Foster City bei San Francisco versuchte nun ein Medikament zu entwickeln, das nach dem gleichen Wirkprinzip arbeitet, aber in Tablettenform verabreicht werden kann. Nachdem dies gelang, begann eine Zusammenarbeit mit der Firma Roche. Im November 1996 begannen die klinischen Studien zur Arzneimittelzulassung.
Im September 1999 wurde Oseltamivir erstmals in der Schweiz zugelassen. In der Europäischen Union wurde 2000 der Antrag auf Arzneimittelzulassung von Hoffmann-La Roche wieder zurückgezogen, weil Mitglieder des Europäischen Arzneimittelauschusses Zweifel am Beleg des Nutzens hatten. Roche wollte Studiendaten nachreichen.[1]
Wie später noch einmal dargestellt, erfolgte am 20. Juni 2002 die Zulassung des Präparates durch die Europäische Arzneimittelagentur für bestimmte Anwendungsgebiete in Therapie und Prophylaxe.[2]
Im Dezember 2000 erhielt Oseltamivir als Wirkstoff gegen Grippe die amtliche Arzneimittelzulassung in den USA und in Japan, anschließend im Juni 2002 auch in der Europäischen Union.
Die Anwendung für Oseltamivir wurde in der Folgezeit erweitert und der Wirkstoff darf nunmehr auch in Europa Kindern von ein bis zwölf Jahren zur Prävention verabreicht werden. In den USA darf das Arzneimittel bereits seit Dezember 2005 bei Kindern diesen Alters vorbeugend eingesetzt werden. Bisher war es zur Grippeprophylaxe erst bei Kindern ab 13 Jahren zugelassen, während es zur Behandlung der Grippe sowohl für Erwachsene als auch für Kinder ab einem Jahr eingesetzt werden konnte. Der ergänzende Zulassungsantrag stützte sich auf die Ergebnisse, die in einer klinischen Studie bei einer Untergruppe von Kindern erzielt worden waren, welche die Behandlung der Grippe mit Oseltamivir in Haushalten untersuchte. Die Studie, an der über 1000 Patienten (Erwachsene und Kinder) teilnahmen, hatte ergeben, dass die Postexpositionsprophylaxe einer Grippeinfektion weiterer Personen im selben Haushalt wirksam vorbeugt und dass die Schutzwirkung des Wirkstoffes bei Kindern zwischen 1 und 12 Jahren ebenso gut war wie in den übrigen Altersgruppen.
Im Jahr 2006 steigerte Roche die Verkäufe von Tamiflu gegenüber dem Vorjahr um 68 % auf 2,6 Milliarden Schweizer Franken. Tamiflu ist damit auf dem 4. Platz der umsatzstärksten Medikamente von Roche (2005: Platz 6).[3]
Herstellung
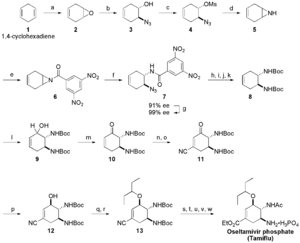
Der Ausgangsstoff für die Herstellung von Oseltamivir ist Shikimisäure in der natürlichen (3R,4S,5R)-Konfiguration. Diese wird heute vor allem aus einem gentechnologisch erzeugten, speziellen Stamm von Escherichia coli–Bakterien gewonnen, kann aber auch aus echtem Sternanis extrahiert werden. 30 kg Anis ergeben ungefähr 1 kg Shikimisäure. Die E. coli–Bakterien produzieren Shikimisäure, wenn sie mit Glucose „überfüttert“ werden. Der extrahierte Ausgangsstoff wird anschließend gefiltert und getrocknet. In der mehrstufigen Synthese treten u. a. hochexplosive Azide als Zwischenprodukte auf. Die Herstellung des Oseltamivir aus dem Ausgangsstoff ist sehr aufwändig.[4]
Forscher der Universität Tokyo, darunter Masakatsu Shibasaki, haben Oseltamivir im Jahr 2006 auch aus einer gebräuchlichen Laborchemikalie, 1,4-Cyclohexadien, synthetisieren können. [5]
Wirkungsweise
Der Wirkstoff Oseltamivir wird nach oraler Einnahme zu mehr als 75 % rasch im Magen-Darm-Trakt vom Organismus in das Blut aufgenommen und nahezu vollständig durch spezielle Leberenzyme (hepatische Esterasen) in das aktive Stoffwechselprodukt (Metabolit) Oseltamivircarboxylat umgewandelt. Dieser Wirkstoff hemmt gezielt (selektiv) die Neuraminidasen von Influenzaviren. Diese Neuraminidasen sind Glykoproteine auf der Oberfläche eines Virions (ein Virus, das noch nicht in eine Zelle eingedrungen ist, oder nach dem Eintritt durch die Replikation neu entstandene Viren, die anschließend als Tochtervirionen diese Zelle wieder verlassen). Sie dienen den nach der Replikation neu entstandenen Viren dazu, Sialinsäure aufzulösen, welche die Wirtszellen bedeckt. Die durch den Metaboliten gehemmten, viruseigenen Neuraminidasen besitzen normalerweise eine enzymatische Aktivität, die für die Freisetzung von neu gebildeten Viruspartikeln aus infizierten Zellen entscheidend ist und damit auch für die weitere Verbreitung der infektiösen Viren im Körper.
Viren verändern mit jeder neuen Generation das Aussehen und die genetische Sequenz ihres Neuraminidase-Enzyms, ein Spalt dieses Enzyms bleibt jedoch unverändert. Er ist für die Auflösung der Sialinsäure von wesentlicher Bedeutung (essentiell) und wird von Neuraminidasehemmern wie Zanamivir bzw. Oseltamivir verstopft.
Oseltamivir vermindert also den Austritt der Tochtervirionen aus den bereits infizierten Zellen und damit die Wahrscheinlichkeit, dass sich das Influenzavirus im Körper weiter ausbreitet. Das Präparat kann so dazu beitragen, dass die Krankheitsdauer geringfügig (im Mittel bei Erwachsenen um einen Tag) verkürzt wird, die Symptome der Grippe gemildert und eventuell gefährliche Folgekomplikationen, wie z. B. Lungenentzündungen, verhindert werden. Ein wissenschaftlicher Beweis für eine Verringerung der Mortalität durch die Einnahme von Tamiflu liegt indes bislang nicht vor.[6]
Einsatz in der Therapie
Um wirksam zu sein, das heißt, um die Symptome einer Virusgrippe zu mindern, wird vom Hersteller vorgegeben, das Medikament so früh wie möglich nach Beginn der Krankheitserscheinungen einzunehmen. Optimal sei ein Behandlungsbeginn innerhalb von 36 Stunden nach dem Auftreten erster Grippesymptome, spätestens sollte der Einsatz nach zwei Tagen erfolgen. Je eher die Therapie beginnt, desto wahrscheinlicher ist ein möglicher Behandlungserfolg.
Nebenwirkungen
Häufigere unerwünschte Wirkungen
Häufige Nebenwirkungen sind Übelkeit, Erbrechen und Magenschmerzen. Ferner können allergische Reaktionen auftreten sowie eine Verschlechterung bereits bestehender Erkrankungen der Atemwege. Um mögliche Nebenwirkungen auf den Magen-Darm-Trakt zu vermeiden, sollte Tamiflu möglichst zusammen mit etwas Nahrung eingenommen werden. Es gibt zurzeit keine gesicherten Erfahrungen mit dem Wirkstoff bei der Behandlung von Patienten mit schweren chronischen Erkrankungen (zum Beispiel bei Asthma, Immunschwäche nach Operationen) oder anderen gravierenden Krankheitszuständen.
Mögliche neuropsychiatrische Vorfälle bei Jugendlichen
Im November 2005 wurden Berichte aus Japan bekannt, denen zufolge Entzündungen im Gehirn und erhebliche neuropsychiatrische Nebenwirkungen bei Kindern und Jugendlichen beobachtet wurden, die infolge einer Influenza-Infektion Tamiflu eingenommen hatten. In Japan wird daher seit einiger Zeit auch auf Bewusstseinstrübungen, Halluzinationen und Krämpfe als mögliche Nebenwirkungen hingewiesen.
Die US-Arzneimittelbehörde FDA kam nach einer Überprüfung zunächst zu dem Ergebnis, dass die Symptome vermutlich auf die Grunderkrankung und nicht auf das Medikament zurückzuführen seien. Eine Steigerung der gemeldeten Fallzahlen neuropsychiatrischer Erkrankungen sei schon aus den 1990er-Jahren bekannt, also bevor Tamiflu eingesetzt wurde. Ursache für diese Steigerung sei unter anderem eine erhöhte Bereitschaft der japanischen Ärzte solche Symptome zu melden. Nach Prüfung von mehr als 100 Fällen von abnormem Verhalten sprachen sich die mit der Prüfung beauftragten Experten der FDA Mitte November 2006 aber ebenfalls dafür aus, auf der Verpackung die Überwachung von Tamiflu-Patienten zu empfehlen, auch wenn noch immer offen sei, ob die neuropsychiatrischen Phänomene auf die Einnahme des Medikaments zurückzuführen seien oder ob es sich um Ereignisse gehandelt habe, die nur zufällig nach Einnahme von Tamiflu auftraten.
Das Committee for Medicinal Products for Human Use (CHMP) der Europäischen Arzneimittelagentur beobachtet zwar ebenfalls die Berichte über mögliche neuropsychiatrische Nebenwirkungen, [7] bekräftigte aber am 17. November 2006, dass die Aussage der Behörde vom gleichen Tag des Vorjahres weiterhin gelte. Am 17. November 2005 hatte die Behörde mitgeteilt, ein ursächlicher Zusammenhang zwischen Tamiflu und den aus Japan beschriebenen Halluzinationen und abnormen Verhaltensweisen sei nicht nachweisbar gewesen.[8]
Am 21. März 2007 verschärfte das japanische Gesundheitsministerium erneut die Warnhinweise. Es wurde vorbeugend angeordnet, dass die Produktinformationen vor einer Verschreibung für Jugendliche warnen müssen.[9] Zugleich wurde jedoch durch das japanische Ministerium erneut festgestellt, dass ein ursächlicher Zusammenhang zwischen Tamiflu und psychischen Störungen (Depressionen) nicht erkennbar sei. In deutschen Presseberichten wurde Ulrich Hagemann, Abteilungsleiter im Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), mit der Aussage zitiert, dass es aus der EU keine Berichte über vergleichbare Auffälligkeiten von Jugendlichen nach Einnahme von Oseltamivir gebe.[10] Gleichwohl empfahl das CHMP am 23. März 2007: "Patienten, insbesondere Kinder und Heranwachsende, sollten genau überwacht und ihre medizinischen Betreuer umgehend informiert werden, falls die Patienten Anzeichen von ungewöhnlichem Verhalten zeigen."[11]
Wechselwirkungen mit anderen Medikamenten
Oseltamivir kann zusammen mit Paracetamol, Ibuprofen oder Acetylsalicylsäure (Aspirin) eingenommen werden, wobei als Wechselwirkung eine Verringerung der Wirksamkeit der Medikamente beschrieben wird.
Resistenzen
Für einiges Aufsehen sorgten die in der Online-Ausgabe der angesehenen Fachzeitschrift Nature dargestellten Fakten zu einem gesicherten Resistenzfall, der auch in der Presse immer wieder (aber meist ohne konkrete Einzelheiten) erwähnt wird [12]. Der Veröffentlichung zufolge wurde in Vietnam ein 21-jähriger Patient erst ganze acht Tage nach dem Auftreten der ersten Krankheitsanzeichen (39,5 °C Fieber und Husten) und einen Tag nach Feststellung einer schweren Lungenentzündung (severe pneumonia syndrome) anschließend für einen Zeitraum von sieben Tagen mit der zur Behandlung von Erwachsenen empfohlenen Tagesdosis von zweimal täglich 75 mg so erfolgreich behandelt, dass er anschließend das Krankenhaus verlassen konnte. Seine 14-jährige Schwester infizierte sich ebenfalls (eventuell sogar bei ihrem Bruder) und wurde ab dem zweiten Tag nach Auftreten von mildem Fieber und leichtem Husten mit der für Erwachsene vorgesehenen prophylaktischen Dosis von einmal pro Tag 75 mg insgesamt vier Tage lang behandelt. Unter dieser Therapie verstärkten sich bei ihr die Krankheitssymptome, und die Patientin bekam daher an den folgenden sieben Tagen die therapeutische Erwachsenendosis (2x75 mg). Unter dieser Wirkstoffdosierung klangen die Symptome schließlich ab, obwohl in Untersuchungsproben vom vierten Behandlungstag (von insgesamt 11) bei dem bei ihr gefundenen Erregervirus und den von diesem angefertigten viralen Klonen von Forschern eine deutliche Resistenz dieses Virusstammes (294S) gegen Oseltamivir festgestellt wurde. Auch diese Patientin konnte das Krankenhaus anschließend wieder verlassen.
Die Autoren der Studie weisen selbst darauf hin, dass anhand dieses Einzelfalles kaum Aussagen darüber möglich sind, wie rasch eine zu niedrige Dosierung nach bereits eingetretener Infektion auch bei anderen Personen zu einer Resistenzbildung führen könnte, empfehlen aber eine genaue Beobachtung der Situation bei den Erkrankten.
Die gleiche, zu verringerter Empfindlichkeit gegen Oseltamivir führende Genveränderung wurde Anfang Januar 2007 bei zwei verwandten Personen nachgewiesen, die am 25. bzw. 28. Dezember 2006 in Ägypten an den Folgen einer H5N1-Infektion verstorben waren. Beide waren seit dem 21. Dezember vergeblich mit Oseltamivir behandelt worden. Die WHO erklärte am 18. Januar 2007, dass es keine Anhaltspunkte gebe, die Oseltamivir-Resistenz sei in Ägypten oder anderswo weit verbreitet.[13]
In der Grippesaison 2007/2008 sind in vier europäischen Ländern gegen Oseltamivir resistente Virenstämme nachgewiesen worden. Insgesamt 13% (19 von 148) der untersuchten Proben wiesen in vitro eine Mutation auf, die eine Resistenz erzeugt.[14] Ende Januar 2008 wurde von norwegischen Ärzten auch bei normalen Grippepatienten ein gegen Oseltamivir resistenter Virusstamm (A/H1N1-H274Y) entdeckt[15], der danach auch weltweit verbreitet gefunden wurde[16]. Für die Grippesaison 2007/2008 in den USA wurde auf Basis von Resistenztestungen ermittelt, dass bei 12,3 % der H1N1-Infizierten eine Resistenz gegen den Wirkstoff vorlag. Aus den vorläufigen Daten zur Grippesaison 2008/2009 zogen die Forscher den Schluss, dass rund 98 % der von ihnen untersuchten H1N1-Virusproben gegen Oseltamivir resistent waren.[17] Daten der WHO von März 2009 bestätigen bei 1291 von 1362 Proben aus 30 Ländern die hohe Resistenzbildung zur Grippesaison 2008/2009.[18]
Zum Stand der Forschung
Ein im Januar 2006 in The Lancet publizierter systematischer Bericht der auf zwei bereits 1999 und 2004 erschienenen Cochrane Reviews (systematischen Übersichtsarbeiten)[19] zur Prävention und Therapie der Influenza basiert, fasst die Evidenz der antiviralen Therapie zusammen. Im Wesentlichen bestätigen T. Jefferson u. a., dass Neuraminidasehemmer eine Infektion mit Influenza nicht verhindern, jedoch den Verlauf lindern können. Dies gilt nicht für die influenzaähnliche Erkrankung, das heißt die Situation, in der eine Virustestung nicht vorliegt und weitere Viren als Verursacher in Frage kommen. Das Präparat Oseltamivir vermindert zudem die Wahrscheinlichkeit einer weiteren Ausbreitung der Influenza im häuslichen Umfeld. Dies wird durch eine Verminderung der Virusausscheidung über die Nase erklärt, die vor allem für die Weitergabe der Infektion verantwortlich ist. Allerdings kommt es nicht zu einer völligen Eliminierung der Virusbesiedlung in der Nase.
Die Autoren gehen daher davon aus, dass der alleinige Einsatz von Neuraminidasehemmern in einer Pandemie aufgrund der in einer solchen Situation sehr viel höheren Viruslast nicht ausreichend ist, um eine Ausbreitung zu kontrollieren. Vielmehr könnte eine zu optimistische Einschätzung der Wirksamkeit von Neuraminidasehemmern zu einem erhöhten Risikoverhalten und somit sogar zu einer Förderung der Virusausbreitung führen. Der Einsatz von Neuraminidasehemmern während einer Influenza-Epidemie ist somit nur bei zusätzlichen Schutzmaßnahmen wie Isolation oder Schutzkleidung Erfolg versprechend. Der routinemäßige Einsatz von Neuraminidasehemmern in üblichen „Grippewellen“ wird aufgrund der fehlenden Wirkung bei den grippeähnlichen Erkrankungen nicht empfohlen. Von Amantadin und Rimantadin wird aufgrund des ungünstigen Nebenwirkungsprofils und der Resistenzentwicklung abgeraten.
Einsatz in der Prophylaxe
Das Medikament kann eingeschränkt zur Vorbeugung eingesetzt werden, wenn im Umfeld bereits ein oder mehrere Influenzafälle eindeutig festgestellt wurden und ein Kontakt mit dem oder den Infizierten nicht ausgeschlossen werden kann. In der Fachinformation von Tamiflu (Stand: Februar 2005) wird allerdings darauf hingewiesen, dass dieses Medikament kein Ersatz für eine Grippeschutzimpfung gegen die bekannten, seit Jahren umlaufenden Humangrippeviren ist. Eine Verwendung zur Vorbeugung sei lediglich angezeigt, wenn eine Impfung vorher aus medizinischen Gründen bei einem Patienten nicht durchzuführen war, oder zu einem Zeitpunkt nicht möglich bzw. nicht mehr effektiv sei, wie zum Beispiel bei einer rasch auftretenden Pandemie.
Als Reaktion auf die aus Japan berichteten, möglichen neuropsychiatrischen Vorfälle bei Jugendlichen empfahl das arznei-telegramm 4/2007: "Angesichts des marginalen Nutzens bei gesunden Kindern und Erwachsenen und des fehlenden Nachweises einer Wirksamkeit bei Patienten mit chronischen kardialen und/oder respiratorischen Erkrankungen raten wir von Oseltamivir bei Virusgrippe ab."[20]
Zur Abschätzung der Folgen einer Einnahme des Medikaments über längere Zeitspannen (Wochen, Monate) gibt es jedoch zurzeit noch keine Studien. Sollte das Medikament zur Langfrist-Prophylaxe eingesetzt werden, ist daher ein Auftreten zusätzlicher, gravierender Nebenwirkungen nicht auszuschließen. Ob der Wirkstoff die Todesrate bei einer Grippe-Epidemie senken wird, ist letztlich ungeklärt. Wie sinnvoll ein Einsatz des Wirkstoffs zur langfristigen Vorbeugung im Falle einer Epidemie tatsächlich sein könnte, lässt sich bislang also nicht eindeutig bestimmen.[21]
Die Anwendung dieses Medikaments und auch anderer in Frage kommender Arzneimittel (wie beispielsweise die Dosierung) bei Behandlung und Prophylaxe der Grippe sollte unbedingt auf der Basis aktueller offizieller Empfehlungen und denen des behandelnden Arztes erfolgen. Mit neuen wissenschaftlichen Erkenntnissen hinsichtlich einerseits der Wirksamkeit und der Nebenwirkungen der Wirkstoffe bei Vorbeugung und Therapie auch und besonders in Abhängigkeit von der Anwendungsdauer und andererseits einer möglichen erregerseitigen Ausbildung von Resistenz gegenüber diesen Arzneimitteln ist jederzeit zu rechnen. Als aktuelle Informationsquelle kann hierzu auch das Robert-Koch-Institut dienen.
Bei der Bevorratung von Tamiflu ist zu beachten, dass es 5 Jahre haltbar ist.
Maßnahmen zur Vorbeugung gegen eine H5N1-Pandemie
Die Weltgesundheitsorganisation (WHO) hat zur Verhinderung einer von ihr befürchteten Influenza-Pandemie durch das Vogelgrippe-Virus H5N1 allen Staaten geraten, so große Mengen dieses Mittels vorrätig zu halten, dass mit ihnen 25 % der Bevölkerung versorgt werden könnten. Das Grippemittel ist möglicherweise geeignet, die Zeit bis zur Entwicklung eines Impfstoffs zu überbrücken. In Laborkulturen und auch in Testtieren wurde eine antivirale Aktivität gegen diesen Subtyp des Influenza-A-Virus nachgewiesen. Auf Grund der geringen Anzahl an erkrankten Personen fehlen jedoch weitgehend klinische Untersuchungen zur Wirksamkeit von Oseltamivir bei der Vogelgrippe.
Nach Frankreich, Norwegen, Großbritannien, der Schweiz und den USA hat auch Deutschland im August 2005 sechs Millionen Dosen des Grippemittels bestellt. Kritiker weisen jedoch darauf hin, dass diese Zahl im Ernstfall viel zu gering wäre: Statt für 25 % (WHO-Empfehlung) oder 20 % (Robert-Koch Institut) der Bevölkerung werden in einigen Bundesländern lediglich für 10 % (Hamburg) bzw. 4,5 % (Sachsen-Anhalt) der Bevölkerung Medikamentendosen vorrätig gehalten.[22] Allein vom Freistaat Bayern wurden 2006 rd. 21,9 Mio. € für die Beschaffung von Medikamenten gegen eine mögliche Influenza-Pandemie ausgegeben.[23] Einem Unternehmenssprecher zufolge verhandle der Hersteller mit der deutschen Regierung über die Lieferung weiterer Dosen. Die französische Zeitung Libération berichtete Ende August, die französische Regierung habe bereits fünf Millionen Dosen des Grippemittels gekauft und beabsichtige, diese Zahl bis Jahresende auf 14 Millionen Dosen zu erhöhen.
Da die Produktion dieses Medikaments sehr viel Zeit erfordert und sehr aufwendig ist, reservieren Staaten und Bundesländer (Niederösterreich, Steiermark, Brandenburg) bereits jetzt dieses Produkt, um im Falle einer Epidemie genügend Vorräte zu haben.
In den Medien
Auch zahlreiche Medienberichte haben wohl dazu beigetragen, dass das Interesse an Oseltamivir und Zanamivir erheblich gestiegen ist. So wurden im Spätsommer 2005 mehr als 130.000 Packungen dieser Arzneimittel verkauft. 2004 waren es im gleichen Zeitraum lediglich 30.000 Packungen. Dies hat, kombiniert mit dem Problem der zeitaufwändigen Wirkstoffherstellung, dazu geführt, dass die Firma Roche die Lieferungen nach Deutschland beschränkt hat.
Einige Medien berichteten, dass die Firma Roche diesen Umsatzzuwachs mehr oder weniger indirekt gefördert habe. So hieß es in einem Beitrag des ARD-Magazins Monitor vom 11. August 2005, Berichte über die Wirksamkeit des Medikaments seien von PR-Abteilungen gezielt an die Medien ausgegeben worden. Dies geschah allerdings nicht als offizielle Werbung, sondern unter dem Mantel eines seriösen journalistischen Beitrags, was viele Redaktionsmitarbeiter wohl nicht erkannt hatten. Aufgrund einiger Rechtsstreitigkeiten wurde der Bericht inzwischen vorsorglich von der Webseite des Magazins entfernt. Als Quelle für diese journalistischen Beiträge wurde meistens das Institut für Gesundheitsaufklärung (kurz: IFGA) genannt. Viele Redaktionen haben offensichtlich diese Angaben nicht weiter hinterfragt, obwohl eine derartige „Öffentlichkeitsarbeit“ von Pharmakonzernen hinlänglich bekannt ist.
Das Nachrichtenmagazin Der Spiegel berichtete am 19. November 2005 indes von einer zunehmenden Besorgtheit des Konzerns um den eigenen Ruf. So habe anhaltende negative Berichterstattung das Image der Firma insbesondere in den USA beschädigt. Tatsächlich wurde in den Medien zuvor vielfach kritisiert, dass sich der Pharmakonzern trotz der sich anbahnenden Gefahr einer Influenza-Epidemie nicht oder nur halbherzig von den Exklusivrechten für das Medikament trenne. Zur Verbesserung des Ansehens plane Roche laut des vorliegenden Berichts, die Zusammenarbeit mit der PR-Firma Fleishman-Hillard zu vertiefen, um so „proaktiv“ Einfluss auf die Medien zu nehmen.
In jüngerer Zeit wird in den Medien auch vor der massenweisen Anwendung gewarnt, weil die damit verbundenen Ausscheidung die Gewässersysteme derart belaste, dass möglicherweise mit einer erheblichen Umweltbelastung der natürlichen Mikroflora und erheblichen Resistenzbildungen bei den Virenstämmen zu rechnen ist.[24]
Einzelnachweise
- ↑ arznei-telegramm
- ↑ Oseltamivir-Richtlinie
- ↑ www.tagesspiegel.de
- ↑ http://www.roche.com/med_mbtamiflu05e.pdf
- ↑ nature.com
- ↑ "Welchen Nutzen haben Neuraminidase-Hemmer bei einer Grippe-Pandemie?" in: arznei-telegramm. A.T.I., Berlin 36.2005, Nr. 7, S. 62f. ISSN 0066-8192
- ↑ emea Pressemitteilung (pdf)
- ↑ European Medicines Agency update on the safety of Tamiflu (emea) vom November 2005 (pdf)
- ↑ www.handelsblatt.com und diverse Agenturmeldungen vom 22. März 2007
- ↑ Meldung der Agentur afp vom 22. März 2007, 16:44 Uhr
- ↑ www.emea.europa.eu Pressemitteilung vom 23. März 2007
- ↑ Le Qm u.a.: Avian flu, isolation of drug-resistant H5N1 virus. in: Nature. London 437.2005, Nr. 7062 (20. Okt.), S. 1108; PMID 16228009.
- ↑ "At this time there is no indication that oseltamivir resistance is widespread in Egypt or elsewhere." Epidemic and Pandemic Alert and Response der WHO vom 18. Januar 2007
- ↑ www.rki.de Robert Koch Institut, 30. Januar 2008: Resistenz gegen den Wirkstoff Oseltamivir bei Influenza A/H1N1-Viren.
- ↑ http://www.ecdc.europa.eu/en/Health_Topics/influenza/news/news_Influenza_080131.aspx##Publichealth_1 PH DEVELOPMENTS – SEASONAL INFLUENZA – ANTIVIRALS; Resistance to Oseltamivir (Tamiflu) found in some European influenza virus samples
- ↑ http://www.who.int/csr/disease/influenza/H1N1webupdate18072008.pdf WHO: Influenza A(H1N1) virus resistance to oseltamivir - 2008 influenza season, southern hemisphere. 18. Juli 2008
- ↑ Dharan NJ, Gubareva LV, Meyer JJ et al. : Infections With Oseltamivir-Resistant Influenza A(H1N1) Virus in the United States.JAMA, 2009;301(10) vom 2. März 2009; doi:10.1001/jama.2009.294
- ↑ [1] Influenza A(H1N1) virus resistance to oseltamivir - 2008/2009 influenza season,northern hemisphere 18 March 2009
- ↑ Jefferson T, Demicheli V, Rivetti D, et al.: Antivirals for influenza in healthy adults: systematic review. In: The Lancet 367, 2006, S. 303–313. [2]
- ↑ arznei-telegramm 2007; 38: 40
- ↑ Science vom 5. August 2005, S. 871. ISSN 0036-8075
- ↑ Netzeitung
- ↑ Bayerischer Oberster Rechnungshof: Jahresbericht 2008, TNr. 8.1, S. 20 (PDF)
- ↑ Andrew Singer, Oxford University, nach Der Spiegel 2007, 5, 130. ISSN 0038-7452
Weblinks
- Reto U. Schneider: Das Rennen um GS4104 - Bericht über die Entwicklung von Tamiflu (NZZ-Folio, 01/2004).
- Empfehlungen der WHO zur Einnahme von Oseltamivir (pdf, Englisch)
- Wirkmechanismus von Tamiflu (durch Animation erklärt)
- Robert Koch Institut: offizielle Empfehlungen zum Management bei Vogelgrippe
- Universität Innsbruck - Fachinformationen u.a. auch zu Tamiflu
- Monografie zu Tamiflu
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.