- Tarceva
-
Strukturformel 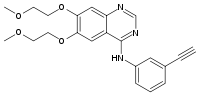
Allgemeines Freiname Erlotinib Andere Namen - N-(3-Ethynylphenyl)-6,7-bis- (2-methoxyethoxy)chinazolin-4-amin
- OSI 774
Summenformel C22H23N3O4 CAS-Nummer 183321-74-6 ATC-Code L01XX34
Arzneistoffangaben Wirkstoffklasse Fertigpräparate Tarceva®
Eigenschaften Molare Masse 393,44 g·mol−1 Löslichkeit schlecht löslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung
unbekanntR- und S-Sätze R: ? S: ? Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Erlotinib (Handelsname Tarceva®, Roche) ist ein selektiver Inhibitor der Tyrosinkinase-Domäne des EGF-Rezeptors. Es ist seit 2005 in Deutschland zugelassen als Arzneistoff gegen Lungenkrebs (Nicht-kleinzelliges Bronchialkarzinom) und seit Anfang 2007 zur Therapie des Bauchspeicheldrüsenkrebs (Pankreaskarzinom).
Inhaltsverzeichnis
Pharmakologie
Erlotinib ist wie Gefitinib ein Tyrosinkinase-Hemmer, der zu einer Blockade des Tumor-Zellwachstums führen kann. Indem Erlotinib die Tyrokinaseaktivität innerhalb der Zelle blockiert, verhindert es die Signalübertragung über den, für das Zellwachstum wichtigen Wachstumsfaktor HER1 (humaner epidermaler Wachstumsfaktor-Rezeptor 1), auch EGFR1 (epidermal growth factor receptor). Erlotinib soll bei fortgeschrittenen Stadien der Krankheit angewendet werden, bei denen eine herkömmliche Chemotherapie versagt hat. Erlotinib führt zu keiner Heilung, kann jedoch die Überlebenszeit dieser Patienten etwas verlängern.
Nebenwirkungen
Die häufigsten Nebenwirkungen von Erlotinib sind ein Akne-ähnlicher Hautausschlag und Durchfall, während die hämatologische Toxizität insbesondere im Vergleich mit alternativen Medikamenten wie Pemetrexed oder Docetaxel gering ist.
Zulassung
Zum Einsatz von Erlotinib als Erstmedikation und in der Kombinationstherapie bei Lungenkrebs werden zurzeit Studien durchgeführt.
Seit November 2005 ist Erlotinib in den USA auch zur Therapie bei fortgeschrittenem oder metastasiertem Bauchspeicheldrüsenkrebs zugelassen, die Zulassung in der Europäischen Union erfolgte im Januar 2007 (für metastasierten Bauchspeicheldrüsenkrebs).
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
