- Thiosulfat-Sulfurtransferase
-
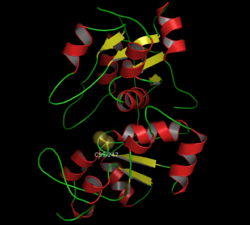
Rhodanase Bändermodell der Rind-Rhodanase mit persulfidiertem Cysteinrest C247 im katalytischen Zentrum (als Kalotte) nach PDB 1BOH Größe 296 Aminosäuren Bezeichner Gen-Name TST Externe IDs OMIM: 180370 UniProt: Q16762 CAS-Nummer: 9026-04-4 Enzymklassifikation EC, Kategorie 2.8.1.1 Transferase Reaktionsart Übertragung eines Schwefelatoms von Thiosulfat Substrat Cyanid, Eisen Produkte Thiocyanat, Schwefel/Eisen-Cluster Die Rhodanase (auch Thiosulfat-Schwefeltransferase, Gen: TST) ist die Bezeichnung für Enzyme, die Schwefel von Thiosulfat auf andere Moleküle übertragen. Mit der Übertragung auf Cyanide werden diese zu Thiocyanaten verändert und damit entgiftet. Die Übertragung auf Eisen produziert die als Kofaktor funktionierenden Eisen-Schwefel-Cluster. Rhodanasen sind in vielen Bakterien und Pilzen zu finden. Die Rhodanasen der Vielzeller sind in den Mitochondrien bzw. den Chloroplasten lokalisiert. Die TST vom Menschen zeigt außerdem schwache Mercaptopyruvat-Schwefeltransferase-Aktivität.[1]
Katalysierte Reaktion
Die Reaktion findet in zwei Schritten statt. Im ersten Schritt wird im katalytischen Zentrum des Enzyms die disulfidische Bindung gebildet, indem der Schwefeldonor, hier Thiosulfat, sein Schwefelatom auf die Thiolgruppe im Cysteinrest C247 1 unter Bildung des Disulfans 2 überträgt. Im zweiten Schritt wird unter Rückbildung der Thiolgruppe das Substrat, hier Cyanid, sulfidiert:
Diese Reaktion ist wichtig für die Entgiftung aufgenommenen Cyanids, da das entstehende Thiocyanat weitestgehend ungiftig ist. Die Verabreichung von Thiosulfat (z.B. in Form einer Natriumthiosulfatlösung) bei Cyanidvergiftungen beruht auch auf der Aktivierung dieses enzymatischen Entgiftungssystems. Vordergründig scheint diese Reaktion die eigentliche Aufgabe der Rhodanase zu sein; über ihre tatsächliche Bedeutung herrscht bislang keine Klarheit. Eine Rolle als Schwefeldonor bei der Synthese von Eisen-Schwefel-Clustern für Eisen-Schwefel-Proteine wird diskutiert.
Rhodanase als Domäne
Die Aminosäuren 25-143 und 173-288 (bei Start-Met als 1) bilden jeweils eine katalytische Proteindomäne, welche auch in mehreren anderen Proteinen zu finden ist, wie beispielsweise Mercaptopyruvat-Schwefeltransferase und M-Phase-Inducer-Phosphatasen.
Einzelnachweise
- F. Gliubich, M. Gazerro, G. Zanotti, S. Delbono, G. Bombieri, R. Berni: Active Site Structural Features for Chemically Modified Forms of Rhodanese. In: Journal of Biological Chemistry. 271, Nr. 35, 1996, S. 21054-21061. PMID 8702871 PDF
Wikimedia Foundation.