- Thyroidhormone
-
Unter dem Begriff Schilddrüsenhormone werden die in den Follikelepithelzellen der Schilddrüse (Thyreozyten) gebildeten Hormone Triiodthyronin (T3) und Thyroxin (Tetraiodthyronin, T4) zusammengefasst.[1] Die Schilddrüsenhormone spielen eine wichtige Rolle für den Energiestoffwechsel und das Wachstum einzelner Zellen und des Gesamtorganismus und sind somit zwingend lebensnotwendig.
Das von den parafollikulären Zellen (C-Zellen) der Schilddrüse gebildete Hormon Calcitonin wird üblicherweise nicht als Schilddrüsenhormon bezeichnet.
Thyronamine sind Hormone, die in vieler Hinsicht gegenteile Wirkungen der klassischen Schilddrüsenhormone haben. Es wird vermutet, dass sie aus Jodothyroninen gebildet werden, dies ist allerdings noch nicht gesichert.
Inhaltsverzeichnis
Chemischer Aufbau
- Hauptartikel Triiodthyronin und Thyroxin
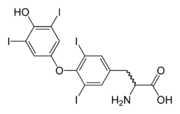
Bei den klassischen Schilddrüsenhormonen aus der Klasse der Jodothyronine handelt es sich um nicht-proteinogene α-Aminosäuren. Sie besthehen aus der Aminosäure Tyrosin, die an ihrem aromatischen Ring im Falle von Triiodthyronin an drei Positionen und von Thyroxin an vier Positionen iodiert sind. Sie unterscheiden sich folglich nur in der Anzahl der gebundenen Iodatome. Die wichtigsten Schilddrüsenhormone sind Thyroxin und Triiodthyronin, ein schwach aktives Schilddrüsenhormon ist Dijodthyronin.
Das von den C-Zellen der Schilddrüse gebildete Calcitonin gehört nicht zur Klasse der Jodothyronine, es ist vielmehr ein Peptidhormon.
Bildung und Freisetzung
Jodaufnahme in die Schilddrüsenfollikel
Für die Synthese der Schilddrüsenhormone wird Iod benötigt, das mit der Nahrung in Form von Iodid-Ionen aufgenommen wird. Die Schilddrüse ist auf eine regelmäßige und ausreichende Iodzufuhr angewiesen. Die Iodid-Ionen werden über das Blut zu den Follikelepithelzellen (Thyreozyten) der Schilddrüse transportiert und von diesen über ein Transportprotein, den Natrium-Iodid-Symporter (NIS) aufgenommen. Dabei nutzt der Natrium-Iodid-Symporter, der in die basolaterale Plasmamembran der Thyreozyten integriert ist, den durch die Natrium-Kalium-Pumpe (Natrium-Kalium-ATPase) energieabhängig aufgebauten elektrochemischen Konzentrationsgradienten für die Natrium-Ionen, so dass Iodid- und Natrium-Ionen zusammen (im Symport) in die Follikelepithelzellen transportiert werden können. Es handelt sich um einen sekundär aktiven Transport.
Mit diesem Transportsystem werden im Zellinneren wesentlich höhere Konzentrationen erreicht, als dies im Extrazellulärraum, also außerhalb der Zelle, der Fall ist. Im Blutplasma ist die Iodid-Konzentration beispielsweise 25 bis 30-fach niedriger als in den Follikelepithelzellen. [2] Die Aktivität des Natrium-Iodid-Symporters wird durch das in der Hypophyse gebildete Thyreotropin (Syn. Thyreoidea-stimulierendes Hormon, TSH) reguliert. Thyreotropin steigert die Aufnahme von Iod in die Thyreozyten.
Am Transport der Iodid-Ionen in das Lumen der Schilddrüsenfollikel sind zwei voneinander unabhängige passive Transportproteine beteiligt, die nur in der apikalen Membran der Thyreozyten lokalisiert sind: Pendrin und der human apical iodide transporter (hAIT). [3]
Iodierung
Das von den von den Thyreozyten durch Proteinbiosynthese gebildete Thyreoglobulin wird durch Exozytose, das heißt durch Verschmelzung von sektetorischen Vesikeln mit der apikalen Plasmamembran der Follikelepithelzellen, in das Lumen der Schilddrüsenfollikel ausgeschüttet.
Das Thyreoglobulin ist reich an Tyrosin-Seitenketten (Tyrosyl-Reste). Tyrosin ist eine Aminosäure und Bestandteil des Thyroglobulins. Die Tyrosinseitenketten werden im Rahmen der Schilddrüsenhormonsynhtese iodiert. Dafür verantwortlich ist ein zu den Peroxidasen gehörendes Enzym, die so genannte Thyreoperoxidase, die in die apikale Zellmembran der Thyreozyten integriert ist und in das Follikellumen ragt. Sie überführt die sehr reaktionsträgen (inerten) Iodid-Ionen (I−) außerhalb der Zellen durch Oxidation und Verbrauch von Wasserstoffperoxid (H2O2) in ein reaktionsfreudigeres Molekül. Dabei handelt es sich wahrscheinlich um kurzlebige Iodonium-Ionen (I+) [4]. Das Wasserstoffperoxid wird durch die ebenfalls in der apikalen Membran integrierte NADPH-abhängige Oxidase (ThOx) gebildet. [5]
Anschließend erfolgt die Iodierung des aromatischen Rings der Tyrosinseitenketten des Thyreoglobulins, zunächst an Position 3, so dass Monoiodtyrosin entsteht, und dann an Position 5 der gleichen Seitenkette, so dass Diiodtyrosin entsteht. Über die Vorstufen Monoiodtyrosin und Diiodtyrosin entsteht durch intramolekulare Kopplung zweier Moleküle zunächst T4. Daraus wird unter Verlust eines Iodatoms T3 gebildet. ([6], Abschn. 1.5.3) Zur Speicherung werden die Hormone an Transporteiweiße, insbesondere Thyroxin-bindendes Globulin (TBG), gebunden.
Freisetzung der Schilddrüsenhormone
Die Schilddrüse setzt etwa 90–95 % T4 (Thyroxin) und nur eine geringe Menge T3 (Triiodthyronin) frei. Davon befinden sich etwa 80 % in der Blutbahn und Leber. Gebildet werden die Hormone in der Drüse durch Anlagerung von Iod an die zuerst synthetisierten und mit einem Kohlenhydratanteil versehenen Aminosäuren. Daher zählt man sie zu den Aminosäure-Derivaten. Thyroxin hat eine Halbwertszeit im Körper von ca. 8 Tagen.
Regulation der Schilddrüsenhormonsynthese und -freisetzung
Die Ausschüttung von Thyroxin wird verstärkt, wenn der Thyroxinspiegel im Blutplasma zu stark absinkt und umgekehrt. Die Aufrechterhaltung des Schilddrüsenhormonspiegels wird dadurch geregelt.
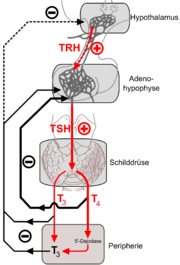
Der Hypothalamus schüttet das TRH (Syn. Thyreoliberin oder Thyreotropin-Releasinghormon) aus. TRH regt die Hypophyse zur Ausschüttung von TSH (Syn. Thyreotropin oder Thyroidea stimulierendes Hormon) an.
Das TSH der Hypophyse bewirkt eine verstärkte Bildung der Schilddrüsenhormone T3 und T4. Die Schilddrüsenhormone gelangen über die Blutbahn an die Zielzellen und entfalten dort ihre Wirkung, wobei sie sich ganz ähnlich wie Steroidhormone verhalten. Über die Blutbahn gelangen die Hormone auch in den Bereich von Hypothalamus und Hypophyse. Diese können mit speziellen Rezeptoren den T3 und T4 Blutspiegel wahrnehmen.
Im Kontext des thyreotropen Regelkreises wird mit wachsendem T3- und T4-Spiegel die Bildung von TRH und TSH zunehmend gehemmt.
Der thyreotrope Regelkreis ist ein mehrschleifiger Regelkreis, der zwischen der Hypophyse und der Schilddrüse aufgespannt ist. Er reguliert die Konzentration an Schilddrüsenhormonen im Blutplasma.
Die Hypophyse schüttet das Steuerhormon Thyreotropin (TSH) aus, das in der Schilddrüse die Sekretion von Thyroxin (T4) und Triiodthyronin (T3) anregt. Umgekehrt hemmen Schilddrüsenhormone im Sinne einer Gegenkopplung (negatives Feedback) die Produktion und Ausschüttung von TSH, so daß sich normalerweise ein Gleichgewichtsspiegel der Menge an Schilddrüsenhormonen im Blut einstellt. Die Produktion und die Ausschüttung des TSH hängt zudem von dem Spiegel des Thyreoliberin (TRH) ab, das vom Hypothalamus produziert und ausgeschüttet wird. Der Hypothalamus gibt den Sollwert der Schilddrüsenhormone im Blut vor und misst ständig den Istwert. Um den Istwert der Schilddrüsenhormone im Blut an den Sollwert der Schilddrüsenhormone im Blut anzupassen, kann der Hypothalamus die Produktionsmenge an TRH und damit die Produktionsmenge an TSH und Schilddrüsenhormonen beeinflussen.
Abgesehen von diesem Hauptregelkreis gibt es weitere eingeschaltete Rückkoppelungsschleifen, z. B. ein Ultra-Short-Feedback von TSH auf seine eigene Ausschüttung, ein Long-Feedback von Schilddrüsenhormonen auf die TRH-Freisetzung und Regelkreise, welche die Plasmaproteinbindung von T4 und T3 einstellen.
Funktionszustände des Hypophysen-Schilddrüsen-Regelkreises
- Euthyreose (Normale Schilddrüsenfunktion)
- Hypothyreose (Schilddrüsenunterfunktion)
- Primäre Hypothyreose (Regelkreis in der Schilddrüse unterbrochen, z. B. durch mangelnde Inkretionsleistung nach Operation oder bei Autoimmunthyreopathien)
- Sekundäre Hypothyreose (Regelkreis in der Hypophyse unterbrochen, z. B. im Rahmen einer HVL-Insuffizienz)
- Tertiäre Hypothyreose (Vorgabe des Sollwertes fehlt durch Mangel an TRH, z. B. im Rahmen einer Schädigung des Hypothalamus, eines Pickardt-Syndroms oder eines Euthyroid-Sick-Syndroms.)
- Hyperthyreose (Schilddrüsenüberfunktion)
- Primäre Hyperthyreose (Inappropriate Sekretion von Schilddrüsenhormonen durch eine Erkrankung der Schilddrüse, z. B. bei Autonomien und beim Morbus Basedow)
- Sekundäre Hyperthyreose (z. B. durch TSH-produzierende Tumoren der Hypophyse)
- Tertiäre Hyperthyreose (durch TRH-Überproduktion im Hypothalamus)
- Thyreotoxikose (Überversorgung mit Schilddrüsenhormonen, z. B. durch zu hochdosierte medikamentöse Behandlung einer Hypothyreose)
- Schilddrüsenhormonresistenz (Unterbrechung des Regelkreises an den Rezeptoren in der Hypophyse oder der Peripherie)
Transport im Blut
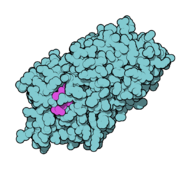 Kalottenmodell des Thyroxin-bindenden Globulins (blau) mit gebundenem Thyroxin (pink) nach Kristallstruktur.[7]
Kalottenmodell des Thyroxin-bindenden Globulins (blau) mit gebundenem Thyroxin (pink) nach Kristallstruktur.[7]Die Schilddrüsenhormone sind nicht wasserlöslich. Sie liegen im zirkulierenden Blut zum größten Teil gebunden an drei Proteinen vor: Thyroxinbindendes Globulin (TBG), Thyroxin bindendes Präalbumin (TTR, auch Transthyretin) und Albumin. Die Bindung ist bei allen Transportproteinen reversibel. Obwohl die Transportkapizät vom Albumin sehr viel größer ist, wird der größte Anteil der Schilddrüsenhormone durch das TBG transportiert - bei Thyroxin sind dies beispielsweise etwa 75 %.[8] Die Ursache liegt in der Affintität zu den Schilddrüsenhormonen, die beim TBG mit Abstand am höchsten ist und beim TTR etwas höher ist als beim Albumin.
Der wesentlich kleinere, aber biologisch aktive Anteil der Schilddrüsenhormone liegt nicht an Proteine gebunden vor, sondern zirkuliert frei im Blut. Sie werden als freies Triiodthyronin (freies T3, fT3) beziehungsweise freies Thyroxin (freies T4, fT4) bezeichnet. Die freien Schilddrüsenhormone machen jeweils nur einen Anteil von etwa 0,3 % aller Schilddrüsenhormone aus.[8]
Medizinische Bezüge
Schilddrüsenhormone, Normwerte Kinder und Erwachsene Freies T3[9]
in pmol/lGesamt T3[10]
in µg/lFreies T4[11]
in ng/dlGesamt T4 [12]
in ng/mlNabelschnurblut 1,6-3,2 0,4-1,3 1,0-1,8 60-131 1. und 2. Lebenstag 5,2-14,3 0,8-2,6 1,6-3,8 107-258 3. bis 30. Lebenstag 4,3-10,6 0,7-2,0 1,5-3,0 78-197 1. bis 12. Lebensmonat 5,1-10,0 1,1-2,3 1,1-1,8 54-138 1. bis 7. Lebensjahr 5,2-10,2 1,2-2,0 0,9-1,7 53-123 7. bis 13. Lebensjahr 6,2-9,5 1,1-2,0 0,9-1,7 60-111 13. bis 18. Lebensjahr 5,2-8,6 1,0-1,8 0,9-1,8 49-107 Erwachsene 3,4-7,2 0,52-2,05 0,73-1,95 43-111 Membrantransport
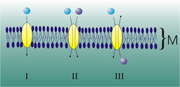
Obwohl Schilddrüsenhormone als lipophile Substanzen auch passiv durch Zellmembranen treten können, gibt es beim Menschen mindestens 10 verschiedene aktive, energieabhängige und genetisch regulierbare Transporter (humane Jodothyronintransporter). Damit wird erreicht, dass der Spiegel von Schilddrüsenhormonen intrazellulär höher als im Blutplasma oder in Gewebeflüssigkeiten liegt[13].
Wirkungsweise
Beim Gesunden dienen die Schilddrüsenhormone der Aufrechterhaltung einer ausgeglichenen Energiebilanz des Organismus. Sie ermöglichen, dass der Stoffwechsel dem jeweiligen Bedarf angepasst werden kann. Im Kindesalter regen die Hormone die Tätigkeit der Körperzellen aller Organe an. Sie fördern in diesem Lebensabschnitt das Wachstum.
Im Erwachsenenalter haben sie auf die Gewebe des Gehirns, der Hoden und der Milz keinen Einfluss, in allen anderen Geweben steigern sie den Stoffwechsel. Die biochemische Wirkung in der einzelnen Körperzelle ist noch nicht ganz genau geklärt.
Wichtig ist aber, dass die Schilddrüsenhormone auf die Tätigkeit anderer endokrinen Drüsen einwirken. So fördern sie die Abgabe des Wachstumshormons STH durch die Hypophyse, greifen in den Glukosestoffwechsel über Steigerung der Insulinfreisetzung aus der Bauchspeicheldrüse ein und regen die Tätigkeit der Nebenniere, besonders der Nebennierenrinde an. Eine Wechselwirkung mit den Sexualhormonen ist ebenfalls bekannt.
Liothyronin (zum Beispiel das verschreibungspflichtige Präparat Thybon) wird manchmal bei der Therapie der Unterfunktion in Kombination mit Thyroxin verschrieben, zum Beispiel wenn der Patient nicht genügend eigenes T3 aus dem Thyroxin bildet.
Tiere
Thyroxin beim Tier
Die Metamorphose von der Kaulquappe zum Frosch wird durch Thyroxin ausgelöst. Zieht man also Kaulquappen in iodfreiem Wasser auf, wird kein Frosch daraus, sondern eine übermäßig große Kaulquappe. Ein in Mittelamerika vorkommendes Amphibium (Axolotl) erreicht bereits als Kaulquappe die Geschlechtsreife und verwandelt sich unter Thyroxinbehandlung in einen sonst nicht existenten Landmolch.
Hunde leiden häufig unter einer Schilddrüsenunterfunktion. Es besteht ein enger Zusammenhang zwischen dem aggressiven Verhalten von Hunden und einer Schilddrüsenunterfunktion. Das gilt auch, wenn die im Blut gemessenen Thyroxinwerte noch innerhalb des klinischen Normbereichs liegen. Ähnlich wie bei Menschen kann das Thyroxin in Tablettenform zugeführt werden. Die Dosis liegt dabei oft weit höher als beim Menschen: 1000 bis 4000 µg pro Tag sind nicht ungewöhnlich.
Quellen
- Dietrich, J. W. (2002). Der Hypophysen-Schilddrüsen-Regelkreis. Entwicklung und klinische Anwendung eines nichtlinearen Modells. Berlin, Logos-Verlag, ISBN 3897228505
- Dietrich, J. W., A. Tesche, C. R. Pickardt und U. Mitzdorf (2004). "Thyrotropic Feedback Control: Evidence for an Additional Ultrashort Feedback Loop from Fractal Analysis." Cybernetics and Systems 35 (4): 315-31.
- Gauna C, G. H. den Berghe, A. J. der Lely (2005). Pituitary Function During Severe and Life-threatening Illnesses. Pituitary 8(3-4): 213-7.
Einzelnachweise
- ↑ Hoffmann-La Roche AG, Urban & Schwarzenberg (Hrsg.): Roche Lexikon Medizin. 4. Auflage. Urban & Schwarzenberg 1998, Stichwort: Schilddrüsenhormon. ISBN 3-541-17114-6.
- ↑ A. Fonyó (Hrsg.): Principles of Medical Physiology (engl.). Medicina Publishing House Co., 1. Aufl. 2002, S. 765 ff. ISBN 9-63-242726-2
- ↑ Lacroix L: Expression of the apical iodide transporter in human thyroid tissues: a comparison study with other iodide transporters. J Clin Endocrinol Metab. 2004 Mar;89(3):1423-8. PMID 15001644
- ↑ G. Löffler, P. E. Petrides (Hrsg.): Biochemie und Pathobiochemie. Springer Medizin Verlag, Heidelberg 2003. 7. Auflage, S. 871 ff. ISBN 3-540-42295-1
- ↑ Caillou B et al.: Expression of reduced nicotinamide adenine dinucleotide phosphate oxidase (ThoX, LNOX, Duox) genes and proteins in human thyroid tissues. J Clin Endocrinol Metab. 2001 Jul;86(7):3351-8. PMID 11443211
- ↑ Jörg Sasse: Dissertation: Plasmakonzentrationen von Prolaktin, Cortisol, Triiodthyronin und Thyroxin bei Schlafentzug-Respondern unter Tryptophan-Depletion im Rahmen einer endogenen Depression. Medizinische Fakultät Charité der Humboldt Universität zu Berlin, 10. Oktober 2000.
- ↑ PDB 2CEO
- ↑ a b Siegenthaler (Hrsg.): Klinische Pathophysiologie. 9. Auflage. Georg Thieme Verlag Stuttgart 2006, Seite 271 ff. ISBN 3-13-449609-7
- ↑ Laborlexikon - Fachzeitschrift für Labormedizin: T3, freies. ISSN 1860-966X (Online-Version: Abruf am 16.02.2008)
- ↑ Laborlexikon - Fachzeitschrift für Labormedizin: T3, Gesamt-. ISSN 1860-966X (Online-Version: Abruf am 16.02.2008)
- ↑ Laborlexikon - Fachzeitschrift für Labormedizin: T4, freies. ISSN 1860-966X (Online-Version: Abruf am 16.02.2008)
- ↑ Laborlexikon - Fachzeitschrift für Labormedizin: T4, Gesamt-. ISSN 1860-966X (Online-Version: Abruf am 16.02.2008)
- ↑ Dietrich, J. W., K. Brisseau und B. O. Boehm (2008). "Resorption, Transport und Bioverfügbarkeit von Schilddrüsenhormonen." Deutsche Medizinische Wochenschrift 133 (31/21): 1644-8. DOI 10.1055/s-0028-1082780
Bitte beachte den Hinweis zu Gesundheitsthemen! Dieser Text basiert ganz oder teilweise auf dem Flexikon, einem Wiki der Firma DocCheck und ist unter GNU-FDL lizenziert.
Wikimedia Foundation.