- Tonkabohnencampher
-
Strukturformel 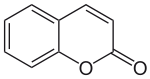
Allgemeines Name Cumarin Andere Namen - 1,2-Benzopyron
- 2H-1-Benzopyran-2-on
- o-Cumarsäurelacton
- Tonkabohnencampher
- Chromen-2-on
- α-Benzopyron
Summenformel C9H6O2 CAS-Nummer 91-64-5 PubChem 323 Kurzbeschreibung farbloses, glänzendes Pulver Eigenschaften Molare Masse 146,14 g·mol−1 Aggregatzustand fest
Dichte 0,94 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 298−302 °C[1]
Dampfdruck Löslichkeit schlecht in Wasser: 1,7 g·l−1 (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cumarin ist der Stoff, der frischem Heu und getrocknetem Waldmeister seinen eigentümlichen, angenehm würzigen Geruch verleiht. In größeren Mengen ist Cumarin gesundheitsgefährdend.
Inhaltsverzeichnis
Vorkommen
Cumarin ist ein natürlich vorkommender sekundärer Pflanzenstoff, der in verschiedenen Ruchgräsern, Schmetterlingsblütlern, beispielsweise dem gelben Steinklee (Melilotus officinalis), im Waldmeister, der Weichselkirsche (Prunus mahaleb), in Datteln sowie in der Tonkabohne (Dipteryx odorata) und auch in der Zimtcassie (auch "-kassie" geschrieben) enthalten ist.
Der Name leitet sich von spanisch cumarú = Tonkabohnenbaum ab.
Cumarin (und verwandte Stoffe) sind für den typischen Heugeruch beim Trocknen von Gras verantwortlich, da Cumarin in der Pflanze teilweise glykosidisch gebunden ist und erst bei Verletzung beziehungsweise beim Welken der Pflanzen durch Abspaltung des Zuckers frei wird. Kommen das Glykosid und die zugehörige Glykosidase, beispielsweise durch Zerstörung oder Verwesung der Pflanzenzelle, zusammen, wird das Glykosid hydrolytisch gespalten, der Stoff (in diesem Falle das Cumarin) wird freigesetzt und kann seine Wirkung entfalten.
Geschichte
Cumarin wurde erstmals im Jahre 1822 aus Tonkabohnen isoliert. Im Jahr 1868 gelang die erste synthetische Herstellung, worauf sie 1876 erstmals vermarktet wurde. Seit 1954 ist Cumarin als Aromastoff in den USA verboten, da in Tierexperimenten toxische Wirkungen festgestellt wurden.[4]
In Deutschland sorgte Cumarin im Winter 2006/2007 für Schlagzeilen, nachdem durch den in Weihnachtsgebäck verwendeten Zimt eine gegenüber dem gesetzlichen Höchstwert vielfach erhöhte Menge des Aromas gefunden wurde. Die Verwendung von Cumarin als Aroma war durch die Aromenverordnung vom 22. Dezember 1981 verboten, später wurde der Grenzwert für Cumarin als Lebensmittelzusatzstoff gemäß Anlage 4 zu § 2 Abs. 3 der überarbeiteten Aromenverordnung (in der Fassung von 1991) bei aktuell 2 mg pro kg zubereiteter Speise festgelegt. Das Verbot von Cumarin wurde durch die Aromenverordnung 1991 jedoch aufgehoben für die Verwendung als Aromastoff in Zubereitungen, die nicht der Ernährung dienen, wie z.B. in Parfums oder Kerzen.
Synthese
Ausgangsstoff für Cumarin in der Pflanze ist die Zimtsäure, aus der es durch Hydroxylierung, Glykosidierung und Cyclisierung gebildet wird. Der Stoff seinerseits ist Grundkörper zahlreicher Naturstoffe, unter anderem des Aesculins, der Furocumarine und des Umbelliferons.
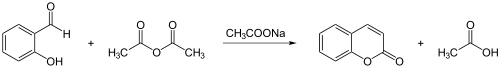
Synthetisch wird Cumarin mit der Perkinschen Synthese aus Salicylaldehyd und Essigsäureanhydrid hergestellt:
Ein alternatives Herstellverfahren ist der Raschig-Prozess aus o-Kresol.
Verbindungen, die das Strukturgerüst des Cumarin enthalten, werden auch unter der Sammelbezeichnung Cumarine geführt.
Verwendung
Cumarin dient vor allem als Duftstoff in der Parfümerie. Daneben wird es (in Form von welken Waldmeisterblättern) auch in der Küche, beispielsweise zum Aromatisieren von Maibowle verwendet.
Aufgrund des vanilleähnlichen Geschmacks wurde seit Anfang des 20. Jahrhunderts Cumarin als Ersatz für die Echte Vanille verwendet. Die Tonkabohne enthält größere Mengen an Cumarin, das daher oft daraus gewonnen wird. Wegen der Eigenschaft von Cumarin, den Geschmack der Echten Vanille vorzutäuschen, wird es auch als Mexikanische Vanille bezeichnet. Die Verwendung von Cumarin als Aromastoff ist jedoch in einigen Gebieten (zum Beispiel USA, Europäische Union) gesetzlich eingeschränkt.[5] Neben dem in Europa heimischen Waldmeister enthalten auch einige Zimtarten, etwa der Cassiazimt - im Gegensatz zu anderen, etwa dem Ceylonzimt - erhebliche Mengen an Cumarin.[6] Cumarin wird über die Haut gut aufgenommen. In Kosmetika darf es in Europa unbegrenzt eingesetzt werden, muss jedoch ab einer bestimmten Menge deklariert werden.
Des Weiteren wird Cumarin als Substrat bei der Markerreaktion für CYP2A6 im in vitro-Metabolismus verwendet. Dabei wird es zu 7-Hydroxycumarin (Umbelliferon) verstoffwechselt.
In Farbstofflasern findet Cumarin als Lasermedium in küvettenförmigen Resonatoren Verwendung.
Derivate
Die blutgerinnungshemmenden Cumarin-Derivate Phenprocoumon und Warfarin werden in der Medizin bei entsprechend risikobehafteten Personen eingesetzt, um ischämische Schlaganfälle zu verhindern. Außerdem werden sie als Rodentizide vor allem zur Bekämpfung von Ratten eingesetzt, da sie in entsprechend hoher Dosierung zu tödlichen inneren Blutungen führen.
Stark fluoreszierende Cumarin-Derivate finden darüber hinaus Anwendung als effektive Farbstoffe in Farbstofflasern und optischen Aufhellern. Als Farbstofflaser emittieren sie im blauen bis in den grünen Spektralbereich des Lichtspektrums.
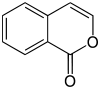
Das Isocumarin (1H-Isochromen-1-on, 1H-2-Benzopyran-1-on[7]) ist ein Stellungisomer des Cumarins, bei dem die Carbonylgruppe und das Sauerstoffatom vertauscht sind.[8]
Einige Dihydro-Isocumarin-Derivate, wie z. B. das Phyllodulcin, das in den Blättern der Gartenhortensie vorkommt, haben einen süßen Geschmack. Die Süßkraft von Phyllodulcin im Vergleich zu Saccharose beträgt 250.[9]
Physiologie
In größeren Mengen oral aufgenommen verursacht Cumarin heftige Kopfschmerzen, Erbrechen, Schwindel und Schlafsucht. Noch höhere Dosen bewirken zentrale Lähmung und Atemstillstand im Koma. Die letale Dosis (LD50) liegt peroral bei der Ratte bei 293 und beim Meerschweinchen bei 202 mg/kg Körpergewicht. Daneben werden Leber- und Nierenschädigungen beobachtet.
Als TDI (tolerable daily intake = tolerierbare tägliche Konsummasse) geht aus Studien des Bundesinstituts für Risikobewertung (BfR) von Anfang 2006 eine Menge von 0,1 Milligramm pro Kilogramm Körpergewicht pro Tag hervor.
Aufgrund der zuvor genannten Gefahren darf Cumarin in Deutschland nicht als Aromastoff zugesetzt werden. Aus Tierversuchen leitet sich der Verdacht ab, dass Cumarin in sehr hohen Mengen krebserregend ist. Mehrere Studien an menschlichen Zelllinien deuten jedoch auf keine Nebenwirkungen im menschlichen Organismus hin.[10][11][12]
Für die bekannte Maibowle aus Waldmeister sollen höchstens 3 g Kraut je Liter Bowle verwendet werden. In dieser geringen Menge ist das enthaltene Cumarin nicht gesundheitsschädlich. Der nach dem Genuss von Maibowle häufig zu beobachtende Kater ist meist mehr auf den Alkoholgenuss als auf das Cumarin zurückzuführen.
Während Cumarin selbst keine gerinnungshemmenden Eigenschaften besitzt, kann es bei einer unsachgemäßen Silo-Lagerung von Heu zu einem Pilzbefall cumarinhaltiger Gräser kommen, wodurch Cumarin-Derivate (Bis-Hydroxycumarine) gebildet werden, die diese Wirkung zeigen. Solches kontaminiertes Heu kann zum Tod der damit gefütterten Tiere führen, da Bis-Hydroxycumarine – als Antagonisten des Vitamin K – die Synthese der in der Leber gebildeten Blutgerinnungsfaktoren (II, VII, IX, X) durch Enzymhemmung beeinträchtigen.
Die Kinetik ist stark artspezifisch. Der Hauptstoffwechselweg im Menschen ist die Hydroxylierung in Position 7 zum ungiftigen Umbelliferon, katalysiert durch das Enzym CYP2A6. In Ratten dominiert hingegen der Stoffwechsel via 3,4-Epoxidierung.[13][14][15] In wässriger, glutathionfreier Umgebung lagert sich das Epoxid (unter Ringöffnung und Decarboxylierung) rasch zum lebergiftigen o-Hydroxyphenylacetaldehyd (o-HPA) um.[16] Dessen Oxidation zur o-Hydroxyphenylessigsäure stellt einen Entgiftungsschritt dar. Die beiden letzten Metaboliten sind in geringen Mengen auch im Menschen nachweisbar.[13]
Quellenangaben
- ↑ a b c d e Sicherheitsdatenblatt Merck
- ↑ Eintrag zu Cumarin in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 28. Dez. 2007 (JavaScript erforderlich)
- ↑ Cumarin bei ChemIDplus
- ↑ Information des Bundesinstituts für Risikobewertung (PDF; 136 kB)
- ↑ Webseite zu Cumarin der Europäischen Behörde für Lebensmittelsicherheit
- ↑ „Fragen und Antworten zu Cumarin in Zimt und anderen Lebensmitteln“ Herausgegeben vom Bundesinstitut für Risikobewertung (PDF; 74 kB)
- ↑ PubChem 68108 (Isocumarin)
- ↑ J. Falbe, M. Regitz (Hrsg.): Römpp Lexikon Chemie. 10. Aufl., Thieme, Stuttgart u. New York, 1996–1999. S. 1998.
- ↑ H.-D. Belitz et al.: Lehrbuch der Lebensmittelchemie. 5. Aufl., Springer, Berlin u. a., 2001. S. 431–432.
- ↑ Weber, US. et al. (1998): Antitumor-activities of coumarin. In: Res Commun Mol Pathol Pharmacol. 99(2); 193–206; PMID 9583093.
- ↑ Elinos-Báez, CM. et al. (2005): Effects of coumarin and 7OH-coumarin on bcl-2 and Bax expression in two human lung cancer cell lines in vitro. In: Cell Biol Int. 29(8); 703–708; PMID 15964220; doi:10.1016/j.cellbi.2005.04.003.
- ↑ Simon Mills, Kerry Bone: Principles and Practices of Phytotherapy. Churchill Livingstone, Edinburgh 1999, 2000, ISBN 978-0-443-06016-8.
- ↑ a b Born SL, Caudill D, Smith BJ, Lehman-McKeeman LD: In vitro kinetics of coumarin 3,4-epoxidation: application to species differences in toxicity and carcinogenicity. In: Toxicol. Sci.. 58, Nr. 1, 2000, S. 23–31. PMID 11053537
- ↑ Born SL, Caudill D, Fliter KL, Purdon MP: Identification of the cytochromes P450 that catalyze coumarin 3,4-epoxidation and 3-hydroxylation. In: Drug Metab. Dispos.. 30, Nr. 5, 2002, S. 483–7. PMID 11950775
- ↑ von Weymarn LB, Murphy SE: CYP2A13-catalysed coumarin metabolism: comparison with CYP2A5 and CYP2A6. In: Xenobiotica. 33, Nr. 1, 2003, S. 73–81. PMID 12519695
- ↑ Born SL, Hu JK, Lehman-McKeeman LD: o-hydroxyphenylacetaldehyde is a hepatotoxic metabolite of coumarin. In: Drug Metab. Dispos.. 28, Nr. 2, 2000, S. 218–23. PMID 10640521
Siehe auch
Weblinks
Wikimedia Foundation.