- Transition und Transversion
-
Mutationen sind genetische Veränderungen, die entweder den Charakter des codierten Proteins erhalten (stille Mutation) oder das Protein funktionell verändern können. Es kann sowohl Unter-, Über oder Nichtfunktion auftreten, außerdem kann es weiter zu einer Änderung der Proteinfunktion selbst kommen. Die Architektur des genetischen Codes verringert die Wahrscheinlichkeit von Schäden im Phänotyp, was in diesem Artikel begründet werden soll.
Grundsätzlich lassen sich zwei Ursachen von Mutationen unterscheiden
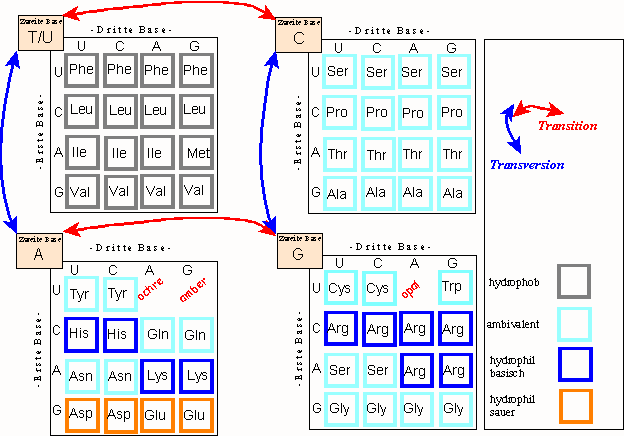
- eine Transition (TI), die den Charakter der Nukleobase erhält. So wird eine Purinbase (A, G) durch die andere Purinbase ersetzt, ebenso verhält es sich bei den Pyrimidinbasen (U/T, C).
- eine Transversion (TV), bei denen eine Purinbase durch eine Pyrimidinbase substituiert wird und umgekehrt.
Transitionen setzen nur einen einfachen chemischen Reaktionsschritt (Desaminierung; Bedeutung von Nitriten) voraus und sind damit häufiger als Transversionen, bei denen zunächst die Base komplett entfernt werden muss (Depurinierung zur Apurinsäure). Hierdurch erklärt sich - teilweise - der "selbst korrigierende" beziehungsweise "konservative" Charakter des genetischen Codes. Darunter versteht man die Tatsache, dass Mutationen entweder "still" (Basenaustausch führt nicht zum Aminosäureaustausch im Protein) oder "konservativ" (neutral) (Basenaustausch führt zum Tausch gegen eine ähnliche Aminosäure) sind. Eine weitere Einflussgröße ist die Degeneration des genetischen Codes, das heißt die Tatsache dass "wichtige" Aminosäuren wie Leu, Arg und Ser durch je sechs Tripletts kodiert werden, während andere Aminosäuren durch nur 4, 3 oder 2 Tripletts repräsentiert werden. Nur Trp und Met kommt ein einziges Codewort zu.
Zunächst soll diese Hypothese aufgrund statistischer Beobachtungen belegt und dann mit der Architektur des genetischen Codes verbunden werden.
Häufigkeit von Aminosäuresubstitutionen
385 Substitutionen in 11 Proteinen, sortiert nach ihrer Häufigkeit (1-16); Transversionen werden in der rechten Spalte durch ein TV gekennzeichnet. Diese Listung der 16 häufigsten Mutationen zeigt nur dreimal das TV davon das erste Mal auf Platz 5.
Nr. Mutation Vorkommen theoretisch durch
Punktmutation realisierbar1 Ala-Ser 44 mal 6x 2 Val-Ile 44 3x 3 Asp-Glu 40 2x 4 Thr-Ser 34 6x 5 Ala-Gly 30 4x (TV) 6 AlaThr 22 4x 7 Ser-Asn 22 2x 8 Ala-Val 20 4x 9 Ser-Gly 18 2x 10 Tyr-Phe 18 2x (TV) 11 Ala-Pro 17 4x 12 Lys-Arg 16 2x 13 Asp-Asn 15 2x 14 Leu-Ile 15 4x 15 Leu-Val 15 6x 16 Ala-Glu 15 2x (TV) Architektur des genetischen Codes
Aus dieser Darstellung folgt, dass der Charakter einer Aminosäure hauptsächlich durch die zweite Triplettposition, das heißt die "zweite Base" bestimmt wird. Die erste Position ist auch von einiger Bedeutung, während der dritten schon aufgrund des Wobble-Prinzips eine untergeordnete Rolle zukommt. So kodiert der gesamte erste Block (zweite Base T beziehungsweise U) ausschließlich hydrophobe Aminosäuren, der zweite (zweite Base C) ambivalente Aminosäuren. Polare Aminosäuren finden sich nur in den unteren Blöcken (zweite Base A oder G), davon alle sauren Aminosäuren im "A-Block".
Weiter gilt:
- Mutationen in der ersten Position sind still oder konservativ (siehe zum Beispiel Zeile 1,2,4 beziehungsweise 3 im ersten Block)
- Transitionen in der zweiten Position (Wechsel im Bereich der oberen beziehungsweise Wechsel im Bereich der unteren Blöcke)ziehen keine dramatischen Änderungen nach sich (siehe z.B. die Val-Ala-Übergänge in der vierten Zeile der oberen Blöcke)
- Transversionen in der zweiten Position können dramatische Veränderungen nach sich ziehen. Das meist zitierte Beispiel, die GAA-GUA Transversion (Wechsel einer Glutaminsäure gegen ein Valin) ist Ursache der Sichelzell-Anämie. Ein derartig seltener Übergang ist außerhalb der obigen Liste häufiger Mutationen.
Weblinks
Wikimedia Foundation.