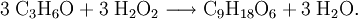- Triacetontriperoxid
-
Strukturformel 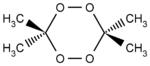
Dimer
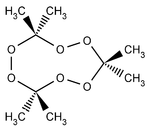
TrimerAllgemeines Name Acetonperoxid Andere Namen Summenformel C6H12O4 (dimere Form)
C9H18O6 (trimere Form)CAS-Nummer 17088-37-8 Kurzbeschreibung farblose monokline Kristalle mit „würzigem“ Geruch Eigenschaften Molare Masse 222,24 g·mol−1 Aggregatzustand fest
Schmelzpunkt 91 °C (Trimer)[1]
Löslichkeit unlöslich in Wasser; schwer löslich in Ethanol, Isopropanol, Glycerin, Eisessig; löslich in Aceton, Ether, Ethylacetat, Hexan, Benzol
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Acetonperoxid (auch bekannt als APEX oder TATP) ist ein hochexplosiver Stoff mit der Schlagempfindlichkeit eines Initialsprengstoffs.
Wie die meisten organischen Peroxide ist auch Acetonperoxid instabil und kann durch Stoß, Wärme, Reibung zerfallen und heftig detonieren, ist aber im Unterschied zu weniger gefährlichen Peroxiden wie Dibenzoylperoxid viel empfindlicher gegen Schlag und Wärme.
Man unterscheidet dimeres, trimeres und tetrameres Acetonperoxid, welche unter unterschiedlichen Bedingungen (z. B. in Abhängigkeit vom benutzten Katalysator) gebildet werden.
Alle Acetonperoxide sind hochexplosiv und bergen dadurch ein hohes Gefahrenpotential. Acetonperoxid sollte nach ersten Angaben der Sicherheitsbehörden (von APEX war in späteren Stellungnahmen keine Rede mehr) bei den Anschlägen auf Londoner Flugzeuge im Jahr 2006 verwendet werden; allerdings ist es unwahrscheinlich, dass es den Terroristen gelungen wäre, den Sprengstoff rechtzeitig zu trocknen.
Acetonperoxid ist nach dem SprengG als explosionsgefährlich eingestuft und wurde der Stoffgruppe A zugeordnet.[3]
Inhaltsverzeichnis
Eigenschaften
- Flüchtig an Luft (würziger Geruch, Substanzverlust durch Sublimation 68,6 % in 14 Tagen)
- Flüchtig mit Wasserdampf oder Ether. Trimeres Acetonperoxid zerfällt beim Erwärmen mit verdünnten Säuren (H2SO4 10 %) unter Rückfluss quantitativ in Aceton und Wasserstoffperoxid
- Es wird von Essigsäureanhydrid nicht verändert und reagiert nicht mit Kaliumiodid-Essigsäure.
- Es wird von 1 N Natronlauge auch beim Erwärmen nicht angegriffen.
- Zinkstaub und Natronlauge reduzieren dimeres Acetonperoxid langsam in der Kälte.
- Reizend (bei nur geringer akuter Toxizität), entzündlich, hochexplosiv
- Besonders empfindlich gegen Zündung durch Flamme, Wärme, Schlag und Reibung
- Lagerung unter Wasser verringert die Empfindlichkeit und verhindert die Sublimation.
- Detonationsgeschwindigkeit: 4500–5500 m/s (Dichte 0,9–1,2 g·cm−3)(trimeres A.)
- Sauerstoffwert: −151,3 %
- Bleiblockausbauchung: 250 ml/10 g (Trimer)[1]
- Schlagempfindlichkeit: 0,03 kp·m = 0,3 Nm (Trimer)[1]
- Reibempfindlichkeit: 0,01 kp = 0,1 N Stiftbelastung (Trimer)[1]
Bildung
Trimeres Acetonperoxid (Schmelzpunkt 97 – 131,5 °C) entsteht bei Einwirken von Wasserstoffperoxid auf Aceton in Gegenwart verdünnter Säuren als Katalysator: [4][5]
Bei Anwesenheit von Salzsäure, Schwefelsäure oder Phosphorsäure verlaufen die Reaktionen, in Abhängigkeit wie viel von dem Katalysator beigemengt wurde, stark exotherm (Explosionsgefahr). Bei mangelnder Kühlung entsteht bei der Reaktion mit Salzsäure unter Kochen das Tränengas Chloraceton.
Die Herstellungsmöglichkeit des dimeren Produktes besteht in der Umsetzung von Aceton mit Peroxomonoschwefelsäure (Carosche Säure)[6] und die Oxidation von Diisopropylether durch Luftsauerstoff oder bei einer Ozonolyse. Bei unsachgemäßer Lagerung von Diisopropylether kann daher Acetonperoxid entstehen. Zur Vernichtung solcher Peroxide werden Kupfer(I)-Verbindungen zur Reduktion eingesetzt.
Tetrameres Acetonperoxid wurde vor wenigen Jahren in obiger Reaktion bei Verwendung von Lewis-Säuren als Katalysator gewonnen.
Acetonperoxid kann in erheblichen Mengen beim bloßen Vermischen von Aceton mit Wasserstoffperoxid-haltigen Lösungen nach mehrtägiger Lagerung des Gemischs entstehen. So entdeckte es der Berliner Chemiker Richard Wolffenstein bereits 1895.
Besondere Gefahren
Acetonperoxid besitzt mehrere Peroxid-Gruppen pro Molekül und ist wie andere, ähnlich gebaute Peroxide äußerst explosiv.
Trimeres Acetonperoxid sublimiert schon bei 14–18 °C, also unterhalb der Raumtemperatur, und detoniert feucht noch bei einem Wassergehalt von 25 %.
Bereits bei 130 °C kann es explodieren. Bei einer Lagerung bei erhöhter Temperatur zersetzt es sich innerhalb weniger Stunden. Auch Reibung und Stoß zwischen zwei harten Materialien, das bloße Öffnen des Gefäßes können das Peroxid zur Explosion bringen. Entsprechend ist auch das Befüllen von Rohren gefährlich. Auch die beim Öffnen eines Schraubverschlusses entstehende Reibungsenergie kann ausreichen, um ein in das Gewinde gelangtes Korn zur Explosion zu bringen, was das gesamte Behältnis zur Explosion bringen würde. Bei Raumtemperatur bilden sich durch Sublimation des Acetonperoxids bereits nach wenigen Tagen im Bereich des Gefäßverschlusses Kristalle, die beim Öffnen explodieren können.
Die Sprengkraft von Acetonperoxid liegt, je nach Testmethode, bei 80–100 % der Sprengkraft von Trinitrotoluol (TNT) und übertrifft damit die von Initialsprengstoffen wie Quecksilberfulminat. Bei direkter Berührung eines Kristalls mit einer Flamme erfolgt jedoch bei diesen Peroxiden meist nur eine relativ harmlose Verpuffung. Bei der Explosion von Acetonperoxid entstehen die für die Sprengwirkung verantwortlichen Gasmoleküle ohne die bei vielen Sprengstoffen übliche Hitzeentwicklung.
In einem Fallhammerversuch mit einem 1 kg-Fallhammer (üblich sind bei normalen Sprengstoffen Untersuchungen mit einem 2 kg-Fallhammer) detoniert es bei Schlag aus nur 3 cm Höhe. Acetonperoxid ist damit einer der schlagempfindlichsten Stoffe.
Wenngleich Acetonperoxid leicht herstellbar ist und sich Experimente damit speziell bei Jugendlichen einer gewissen Beliebtheit erfreuen (Slangname auch „Apex“), ist dieser Stoff außerordentlich instabil und gefährlich und unterliegt darüber hinaus dem Sprengstoffrecht (insbesondere der Erlaubnispflicht des § 27 Sprengstoffgesetz[7], sofern keine Ausnahmen nach der 1. Verordnung zum Sprengstoffgesetz für Forschung und Lehre greifen).
Als chemisches Experiment wird an Schulen und Universitäten gelegentlich das Erhitzen weniger Milligramm feuchten trimeren Acetonperoxids frei auf einer stabilen Eisenplatte bis zum Detonieren des Peroxids vorgeführt. Hier sollte besser auf das Hexamethylentriperoxiddiamin (HMTD) ausgewichen werden, das bei geringerer Schlagempfindlichkeit und fehlender Tendenz zur Sublimation den gleichen didaktischen Vorführungswert hinsichtlich der Verpuffung oder Detonation hat.
Acetonperoxid lässt sich nicht mit herkömmlichen, auf Nitroverbindungen empfindlichen Sprengstoffdetektoren detektieren.
Geschichtliches
Acetonperoxid wurde im Jahre 1895 von Richard Wolffenstein an der Technischen Hochschule Berlin bei der Untersuchung der Oxidation von Coniin mit Wasserstoffperoxid in Aceton als Lösungsmittel zufällig entdeckt. Ein Herstellungsverfahren für Acetonperoxid wurde von ihm im Jahre 1895 unter der Nummer D.R.P. 84953 in Deutschland zum Patent angemeldet. Baeyer und Villiger publizierten im Jahre 1899 und 1900 einige Artikel über die Bildung dimeren und trimeren Acetonperoxids. Im Jahre 1925 wurde es zwar unter der Nummer D.R.P. 423,176 in Deutschland und verschiedenen anderen Ländern von den Sprengstoffwerken Dr. R. Nahnsen & Co. AG, Hamburg als angeblich sicherer und stabiler Initialsprengstoff zum Patent angemeldet.
Die extreme Schlagempfindlichkeit, Flüchtigkeit (6,5 % in 24 h bei 14–18 °C) und mangelnde Stabilität verhinderten jedoch jegliche praktische Nutzung (vgl. Rohrlich/Sauermilch) aufgrund der großen Gefährlichkeit.
A. E. Thiemann schlug im Jahre 1942 die Nutzung von Acetonperoxid als Zusatz zur Verbesserung der Zündwilligkeit des Dieselkraftstoffs vor.
Tetrameres Acetonperoxid wurde erst im Jahre 1999 von chinesischen Forschern entdeckt.
Acetonperoxid sorgte immer wieder aufgrund unbeabsichtigter Bildung für spektakuläre Arbeitsunfälle, so z. B. 2001 in einem Labor an der Universität Bonn, wo ein 55-Liter-Abfallfass mit Chemikalienabfällen gefüllt wurde, die Acetonperoxid bilden konnten. Allerdings erfolgte hier kein Nachweis, ob tatsächlich eine Peroxidbildung erfolgt war.[8] [9]
Bei einem geplanten Anschlag auf mehrere Flugzeuge während des Fluges in die USA, der am 10. August 2006 in London verhindert werden konnte, sollte möglicherweise Acetonperoxid verwendet werden.[10] Die Attentäter hätten die Rohstoffe (Aceton und Wasserstoffperoxid) in flüssiger Form in Trinkgefäßen in die Flugzeuge schleusen und dort den Sprengstoff ohne weiteren Katalysator herstellen können.[10] Die Praktikabilität eines solchen Unterfangens wird von Experten jedoch bezweifelt[11]. Ohne Säurekatalyse erfolgt allerdings selbst nach mehrwöchigen Stehen der Mischung aus Aceton und Wasserstoffperoxid keine Reaktion, wie schon Wolffenstein 1895 nachweisen konnte; es wäre also zusätzlich noch eine Säure benötigt worden. Auch müsste das Peroxid nach der Herstellung von der Lösung abfiltriert werden. Die nachfolgende nötige Trocknung würde mehrere Stunden auf dem Filter dauern. Somit ist die „Flugzeugvariante“ in dieser Ausführung sehr unwahrscheinlich. Ebenso sollte es angeblich in sehr großer Menge (700 kg) bei einem Attentatsversuch in Deutschland verwendet werden. Die tatsächliche Durchführbarkeit dieses Plans ist jedoch sehr kritisch zu sehen. Die extreme Empfindlichkeit des Stoffes verhindert einen tatsächlichen Einsatz wirksam. [12]
Acetonperoxid kann am besten in Aceton und unter dessen Lösungsvermittlung in Diesel oder Biodiesel eingebracht werden. Aber auch die Löslichkeit in Aceton ist beschränkt und dürfte die 25 % nicht überschreiten. In Dieselkraftstoff oder Pflanzenöl erhöht es die Cetanzahl. Da es preisgünstigere und ungefährlichere Lösungen gibt, wird es für diesen Zweck nicht verwendet.
Quellenangaben
- ↑ a b c d Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, 10., vollständig überarbeitete Auflage, Wiley-VCH 2008, ISBN 978-3-527-32009-7
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Feststellungsbescheid Nr 413 der BAM
- ↑ Wolffenstein, 1895.
- ↑ Bayer u. a., 1900.
- ↑ R. W. Murray, R. Jeyaraman: Dioxiranes - Synthesis and Reactions of Dioxiranes. in: Journal of Organic Chemistry. Washington 50.1985,16, 2847-2853. ISSN 0022-3263
- ↑ Sprenggesetz 1976
- ↑ Giftfass Bonn
- ↑ Giftabfälle
- ↑ a b Heise Newsticker
- ↑ Der Spiegel
- ↑ Anschlag mit Apex undurchführbar?
Literatur
- Richard Escales: Initialexplosivstoffe. Survival Press, Radolfzell 2002. ISBN 3-8311-3939-3
- Deutsche Chemische Gesellschaft (Hrsg.): Beilsteins Handbuch der organischen Chemie. Hrsg. v. Beilstein-Inst. für Literatur der Organ. Chemie. 31 Bde. Springer, Berlin 1918-31 (4.Aufl.).
- R. Wolffenstein, in: Berichte der deutschen Chemischen Gesellschaft. Friedländer, Berlin 28.1895, S.2265. ISSN 0365-9496
- Tadeusz Urbanski: Chemie und Technologie der Explosivstoffe. Bd 3. VEB deutscher Verlag für Grundstoffindustrie, Leipzig 1964, S.194ff.
- Basil T. Fedoroff u. a.: Encyclopedia of Explosives and related items. Technical Report 2700. 11 Bde. Picatinny Arsenal, Dover NJ 1960ff.
- Bd 1. Dover NJ 1960, S.A-41.
- Bd 7. Dover NJ 1975, S.H-83.
- M. Rohrlich, W. Sauermilch, in: Zeitschrift für das gesamte Schieß- und Sprengstoffwesen. München 98.1943, S.38. ISSN 0372-8935
- Tenney L Davis: Chemistry of Powder and Explosives. Wiley, New York 1941-1943.
- A. E. Thiemann, in: Automobiltechnische Zeitschrift (ATZ). Vieweg, Stuttgart 45.1942, 454. ISSN 0001-2785
- H. Jiang, G. Chu, H. Gong, Q. D. Qiao, in: Journal of chemical research. Synopsis, London 288.1999. ISSN 0308-2342
- J. Gartz: Vom griechischem Feuer zum Dynamit – eine Kulturgeschichte der Explosivstoffe. E. S. Mittler & Sohn, Hamburg 2007. ISBN 978-3-8132-0867-2
Weblinks
Wikimedia Foundation.