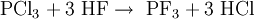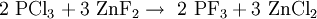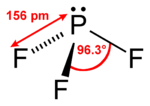- Trifluorphosphan
-
Strukturformel 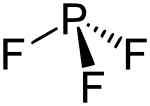
Allgemeines Name Phosphor(III)-fluorid Andere Namen Phosphortrifluorid, Trifluorphosphan
Summenformel PF3 CAS-Nummer 7783-55-3 PubChem 62665 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 87,97 g·mol−1 Aggregatzustand gasförmig
Dichte 3,96 g·l−1 (0 °C)[1]
Schmelzpunkt Siedepunkt −95,2 °C[1]
Dampfdruck 69 bar (20 °C)[1]
Löslichkeit mit Wasser Hydrolyse[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Giftig Ätzend (T) (C) R- und S-Sätze R: 23-35 S: 9-26-36/37/39-45 MAK nicht festgelegt[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phosphor(III)-fluorid ist ein giftiges, in geringen Konzentrationen geruchloses, farbloses Gas. In Wasser hydrolisiert es langsam, in Alkalien schnell zu Phosphonsäure bzw. Phosphonaten. Mit vielen Lewis-Säuren bildet es stabile Komplexe.
Inhaltsverzeichnis
Gewinnung und Darstellung
Phosphortrifluorid wird üblicherweise durch Halogenaustausch aus Phosphortrichlorid mittels Fluorwasserstoff, Arsenfluorid, Calciumfluorid oder Zinkfluorid hergestellt.
Eigenschaften
Physikalische Eigenschaften
Das Molekül ist trigonal-pyramidal gebaut und verfügt über einen Bindungswinkel von 96°. Die Phosphor-Fluor-Bindung ist 156 pm lang, die Bindungsenthalpie beträgt bei Standardbedingungen 499 kJ/mol.
Das Phosphoratom gibt bei der Kernresonanzspektroskopie bei einer chemischen Verschiebung von 97 ppm ein Signal.
thermodynamische Eigenschaften Eigenschaft Wert ΔfH0g −919 kJ/mol ΔfG0g −898 kJ/mol S0g 273 J/(mol·K) Cp0g 59 J/(mol·K) p 3,4 · 10−30 C·m Chemische Eigenschaften
Phosphor(III)-fluorid hydrolisiert in Wasser langsam, in Alkalien schnell zu Phosphonsäure und Fluorwasserstoffsäure bzw. Phosphonaten und Fluoriden. Im Vergleich zu Phosphortrichlorid hydrolisiert Phosphortrifluorid aber langsamer. Phosphortrifluorid ist eine sehr schwache Lewis-Säure aber eine sehr starke Lewis-Base. Also solche bildet es mit vielen Lewis-Säuren stabile Komplexe. Bei vielen Metallcarbonylen ist es außerdem in der Lage, das Kohlenstoffmonoxid zu verdrängen und zu ersetzen.
Verwendung
Großtechnisch findet Phosphortrifluorid keine Verwendung, in der Forschung wird es aber in der organischen Synthese und zur Herstellung von Komplexen Verwendung.
Biologische Bedeutung
Phosphor(III)-fluorid ist für den Menschen stark giftig, da es wie Kohlenstoffmonoxid irreversibel an Hämoglobin bindet und somit die Sauerstoffatmung verhindert.
Quellen
- ↑ a b c d e f g Eintrag zu CAS-Nr. 7783-55-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18.8.2007 (JavaScript erforderlich)
- CRC Handbook of Chemistry and Physics, 60th Edition, 1980, CRC Press, Inc.
- Holleman/Wiberg: Lehrbuch der Anorganischen Chemie, 101. Auflage, 1995, Walter de Gruyter & Co
- G.H. Aylward, T.J.V. Findlay: Datensammlung Chemie in SI-Einheiten, 3. Auflage, 1999, Wiley-VCH
Wikimedia Foundation.